光アライアンス 2024年1月号
紫外光を用いた温室効果ガス分解技術
=N2OとCH4を常温・常圧・無触媒で分解し、温暖化を抑制=
ウシオ電機㈱ 大塚 優一・鮫島 貴紀
1.はじめに
産業革命以降、地球の平均気温は上昇し続け、地球温暖化対策は喫緊の課題となっている。地球温暖化の原因となる温室効果ガスとして、二酸化炭素(以下CO2)、メタン(以下CH4)、一酸化二窒素(以下N2O)、フロンガス等が知られている。これらのガスの中で、CO2の排出量が一番多く、次いでCH4、N2Oの順に排出量が多い。図1に示す通り、CO2換算ベースでこれら3種類のガスは温室効果ガス総排出量の97 %もの割合を占めている。
また、CO2を基準にして、他の温室効果ガスがどれだけ温暖化させる効果があるかを表した数字である地球温暖化係数(GWP:Global Warming Potential)はCH4が25、N2Oに至っては298であると報告されており、温暖化に与える影響は大きい。これら、CH4やN2Oの排出源としては、下水処理場や焼却炉、産業排水の処理、畜産排せつ物管理場、農耕地土壌などが挙げられる(1)。特にこれらの場所から排出されるCH4やN2Oは濃度が低く、低温触媒での分解や放出されたガスの捕集が難しく、現状ではその対策が困難な状態である。
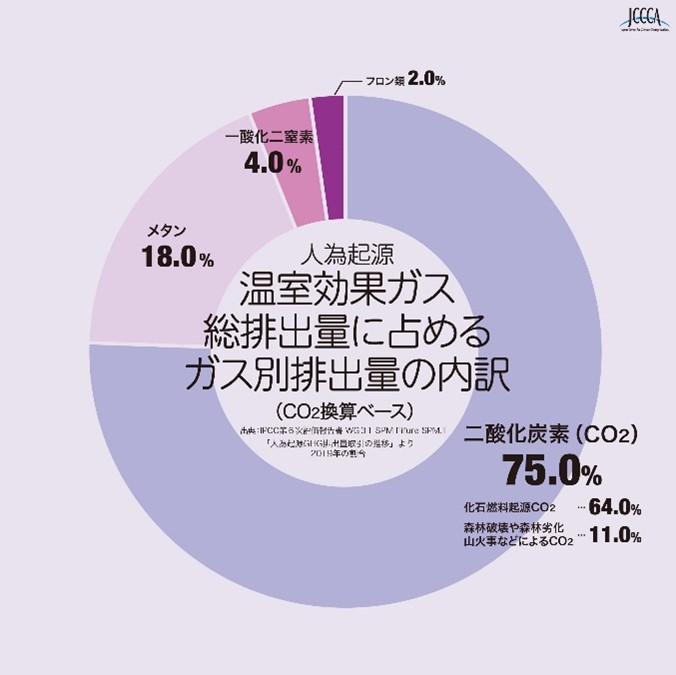
図1 温室効果ガス総排出量に占めるガス別排出量
出典:全国地球温暖化防止活動推進センターウェブサイト(https://www.jccca.org/)
出典:全国地球温暖化防止活動推進センターウェブサイト(https://www.jccca.org/)
2.光化学反応を利用した新たな分解方法
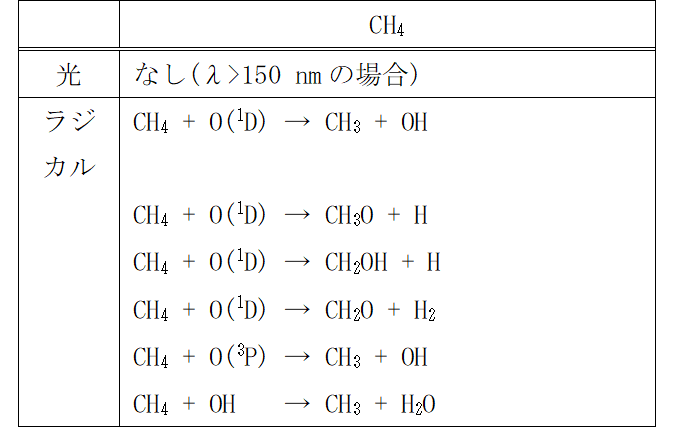
そこで、この課題に対し、意図せず排出されるN2OとCH4を直接的に分解するといった新たなアプローチから解決策を検討した。従来、N2O とCH4の分解方法として、高温燃焼や高温触媒方式が良く知られている。前者は、燃焼によって大量のCO2を排出してしまうこと、後者は触媒が高価であることや還元剤としてアンモニアを利用することによる排水処理が課題である。また、N2Oの分解としてプラズマによる方式も検討されているが、空気中でプラズマを発生させると環境汚染物質であるNOxを生成するほか、条件によってはN2Oが増えてしまうという課題がある。加えて、前述した排出源から排出されるN2OとCH4は数十~数百ppmとかなり希薄であることも処理を困難にしている要因である。これらの課題を解決すべく、新たな試みとして「光」や光によって生じる「ラジカル(活性化学種(O(1D),O(3P),OH))」を用いた化学反応によるN2Oと CH4の分解を検討した。各気体分子の「光」と「ラジカル」による反応初期過程(2)を表1にまとめる。なお、O(1D)は励起状態の酸素原子、O(3P)は基底状態の酸素原子である。
表1 N2Oと CH4の「光」と「ラジカル」による反応初期過程



3.N2OとCH4の分解に用いるキセノンエキシマランプ
エキシマランプは1993年に世界で初めてウシオ電機が製品化した誘電体バリア放電を活用したランプ光源であり、液晶基板の洗浄工程や半導体製造工程に応用展開され、高シェアを誇るランプである。
誘電体バリア放電の大きな特徴は、通常の放電ランプと異なり放電電極間に誘電体(ガラス、セラミックス等)が存在することである。誘電体が存在することでアーク放電への移行を防げ、エキシマ発光を可能にしている。また誘電体に囲まれた放電空間に充填された放電ガスが放電によってエキシマ発光するが、発光する波長特性は放電ガスの種類により決まることも特徴の一つである。Ar2*は126 nm、Kr2*は146 nm、Xe2*は172 nm、KrCl*は222 nm、XeCl*は308 nmにピーク波長を持つ。これら各エキシマランプの分光スペクトルを図2に示す(3)。
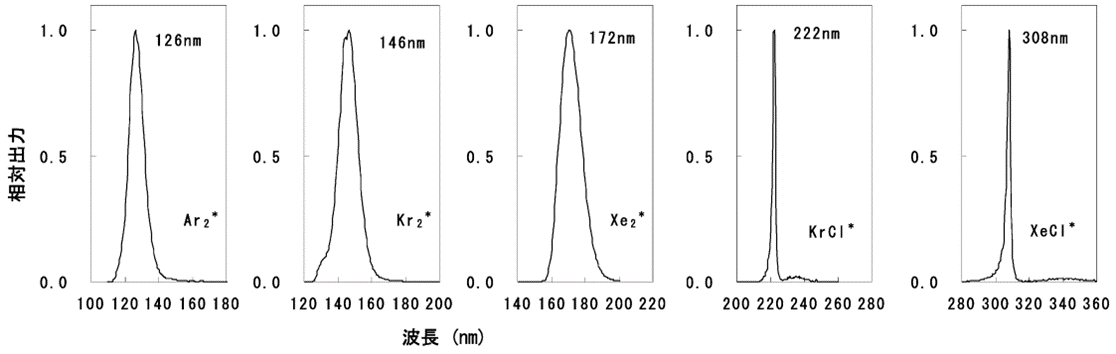
図2 各エキシマランプの分光スペクトル
光化学反応によるN2OとCH4の分解における反応初期過程に必要な光波長(340 nm以下)と、ラジカル(O(1D),O(3P),OH)を生成できる光源として、波長172 nmの紫外光を放出できるキセノンエキシマランプ(以下、エキシマランプ。図3)がある。

図3 キセノンエキシマランプ
分解に必要なラジカル(O(1D),O(3P),OH)の生成反応は以下の通りである。エキシマランプから生じる紫外線によって、空気中に含まれる酸素(以下O2)や水分(以下H2O)が分解され、効率的にラジカルが生成する。
O2 + hν(λ<242 nm) → O(3P) + O(3P)
O2 + hν(λ<175 nm) → O(3P) + O(1D)
H2O + hν(λ<242 nm) → OH + H
さらには、以下の通り生成されたラジカルからオゾン(以下O3)が作られ、そのオゾンもまた光分解によりラジカル(O(1D),O(3P))を生成する。なお、Mは空気中の窒素(以下N2)やO2やである。
O(1D) + M → O(3P) +M
O2 + O(3P) → O3
O3 + hν(λ<1180 nm) → O(3P) + O2
O3 + hν(λ<411 nm) → O(1D) + O2
これらの特徴を持つエキシマランプを用いて光化学反応によりppmオーダーの低濃度N2OとCH4の分解が可能かを確認した結果を紹介する。今回はガスの排出源として下水処理場の水処理工程から排出されるガスでの分解実験を行った。
4.分解実験方法
分解実験の実験系を図4に簡易的に示す。分解実験は模擬ガスと実ガスの2種類のガスで行った。模擬ガスでの実験では、AirおよびN2O、CH4のボンベを用いて、N2Oの濃度を50 ppmまたは100 ppm、CH4の濃度を200 ppmとなるようにマスフローコントローラにて調整し、混合させた。ガスの流量が0.1~1.0 L/minとなるように調整し、光反応装置へ処理ガスを供給した。一方、実ガスでの実験は、国内の下水処理場の生物反応槽からの排ガスをサンプリングバッグに捕集したガスを使用した。実際の排ガスにはN2O 30 ppm,CH4 60 ppm,CO2 7500 ppm,水(以下H2O) 4500 ppmが含まれていた。サンプリングバッグからポンプと流量計を用いて172 nmを照射する光反応装置へ処理ガスを供給した。この時、流量は0.1~1.0 L/minに調整した。光反応装置を通過したガスの成分を、フーリエ変換赤外分光光度計(FT-IR)によって分析した。
a.模擬ガス
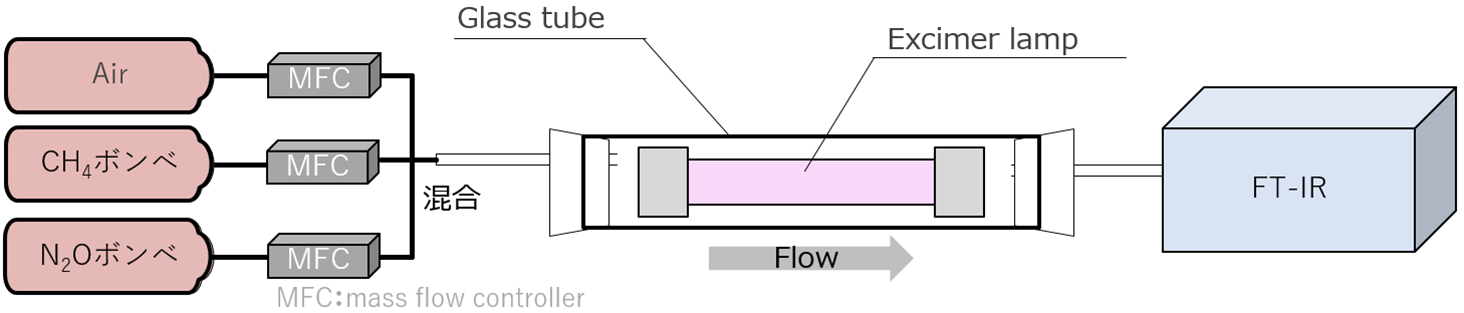
b.実ガス
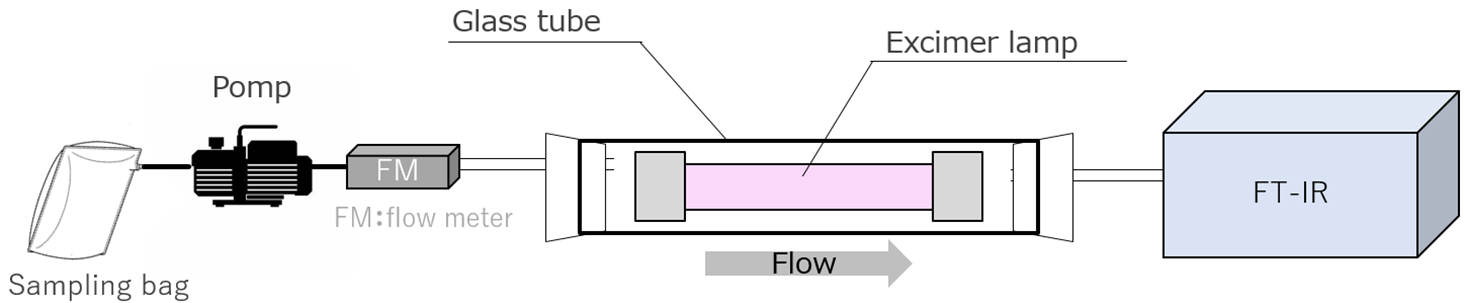
図4 実験系 (a.模擬ガス b.実ガス)
5.結果および分解のメカニズム
各ガス流量に対するN2OとCH4の分解率を図5に示す。ここで分解率は
分解率 = [分解された量] / [処理前のガスに含まれていた量] × 100 (%)
として算出した。N2Oの分解率は、処理前のガスに含まれていたN2Oの濃度や、模擬ガスか実ガスかによる差はほとんど見られず、どの条件でも同じ傾向が見られた。本実験系ではN2O濃度が50 ppmでガス流量が0.1 LPMのとき、最大で63.3 %の分解率が得られた。一方、CH4は流量が多い時の実ガスの分解率は模擬ガスに比べて少し低い結果となったが、CH4濃度が60 ppm,200 ppmでガス流量が 0.1 LPMのとき、および、CH4濃度が200 ppmでガス流量が 0.2 LPMのとき、100 %分解された。

図5 各ガス流量に対するN2O・CH4の分解率
まず、光によるN2Oの直接分解メカニズムについて考察する。本実験に使用したエキシマランプから1秒あたりに放出される光子の数は、照度および照射面の表面積から2.49×1019 個/secと求められる。一方で1秒間に流れる処理ガスに含まれるN2Oの分子の数は本実験条件では1.14×1015~3.79×1016 個/secであり、光子数よりも少ないため光子が十分に利用されれば分解は可能である。しかし、実際にはN2Oは100 %分解されておらず、光を吸収できていないN2O分子がいると考えられる。ガスに含まれる各成分の光の吸収しやすさは、分子1個あたりの光子の吸収しやすさ(吸収断面積)と、分子の濃度の積で評価することができる。図6に、N2OとO2の、各波長の光の吸収しやすさを示す。縦軸はそれぞれの分子の吸収断面積[cm2]と濃度[%]を乗じた数値であり、指数表示としている。また、N2Oの濃度は100 ppmで計算した結果を示す。図6より、172 nmにおいてO2の光の吸収しやすさはN2Oの約13,000倍であり、N2Oに吸収される光子数(N2Oの直接光分解に使われる光子数)よりも、O2に吸収される光子数の方が非常に多いことがわかる。これは、172 nmにおけるN2Oの吸収断面積がO2に対して小さいことと、O2濃度が約21 %とN2O濃度(100 ppm)より非常に高いことに起因している。
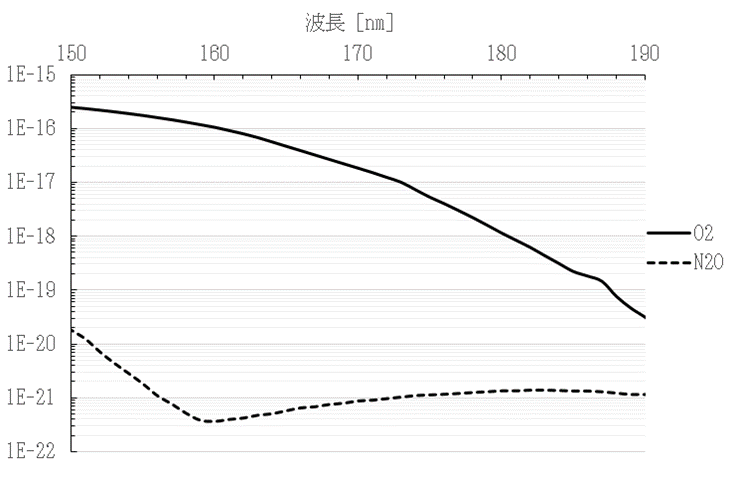
図6 各波長におけるN2OとO2の吸収されやすさ
次に、ラジカルによる分解メカニズムについて考察する。一般的に、化学反応A+B→Cの速さrは、 r = k × (Aの濃度) × (Bの濃度) のように反応物の濃度に比例し、その比例定数kを反応速度定数という。
O2に吸収された光子は光化学反応を起こし、O(1D),O(3P)といったラジカルを生成する。表1に示したように、O(1D)はN2OとCH4の分解に寄与し、O(3P)はCH4の分解のみに寄与する。O(1D)はエネルギーが高く、周囲に大量にあるN2やO2などと衝突しすぐに失活してO(3P)となる。N2、O2、N2OのO(1D)との反応速度定数はそれぞれ2.0E-11 cm3/(molecule・s)、3.0E-11 cm3/(molecule・s)、1.2E-10 cm3/(molecule・s)であり、その違いは最大で1桁程度である。一方で、N2、O2の濃度がそれぞれ約78%、約21%であるのに対して、N2Oの濃度は100 ppmと3桁以上小さい。したがって、化学反応の速さを考えるとN2Oの分解に使われるラジカルは少なくなる。これらの要因により、100 %分解されなかったものと考えられる。
CH4の分解において、流量が多い時の実ガスの分解率は模擬ガスに比べて少し低かった。これは、実ガスには水分が含まれており、172 nmにおけるH2Oの光吸収が非常に高いことから、O2に吸収される光子の量が少なくなり、その結果O(1D),O(3P)のラジカルが少なくなったためであると考えられる。一方でH2Oが光子を吸収すると、光化学反応によってOHラジカルが生成するので、CH4の分解が期待される(表1)が、実際には全体的にH2Oの濃度が低く反応に寄与しなかったと考えられる。なお、CH4は分解されると最終的にはCO2まで酸化される。CO2も温室効果ガスではあるが、冒頭述べた通りCH4の地球温暖化係数はCO2の25倍であるため、CH4を分解してCO2が生成されても温暖化を抑制できると考えられる。
6.結論
エキシマランプを用いた光化学反応により常温・常圧・無触媒でppmオーダーの低濃度N2OとCH4を一括して分解することが可能であることが確認できた。また、実際に下水処理場の水処理から排出される実ガスにおいても分解が可能であることが確認できた。本実験系でのN2O分解において、N2O濃度が50 ppmでガス流量が0.1 LPMのとき、最大で63.3 %分解され、CH4分解においては、CH4濃度が60 ppm,200 ppmで ガス流量が0.1 LPMのとき、および、CH4濃度が200 ppmで ガス流量が0.2 LPMのとき、100 %分解されることが確認された。
7.さいごに
例えば下水処理場から排出されるガスに対して本技術を用いると、当社が保有する技術(4)により、N2Oから硝酸を生成することができる。硝酸は、火薬・染料・セルロイドなどの製造に使われるほかアンモニアと作用させて、硝酸アンモニウム(硝安)を作ることができる。硝酸アンモニウムは、非常に窒素分の多い肥料で硫酸アンモニウムにかわる窒素肥料として活用される。この肥料を植物の栄養源とすることで植物が育成する。育成された植物を家畜や人間が食し排せつ物として下水処理場へ戻ってくる。即ち、窒素を固定化し、硝酸利用により窒素循環を実現することになる。また、CH4が分解されてできるCO2は水処理工程から排出されるCO2と合わせてCCUS等の技術を用いて炭素循環社会にも資するものである(図7)。なお、本研究は国土交通省の「令和5年度下水道応用研究で実施する研究テーマ」に採択された。ウシオは今後も本技術の実用化に向け、更に研究開発を加速し、本技術を様々な排出源への社会実装を通して「地上炭素ネットゼロと、人々の幸せを両立できる世界」に「光」で貢献していく。
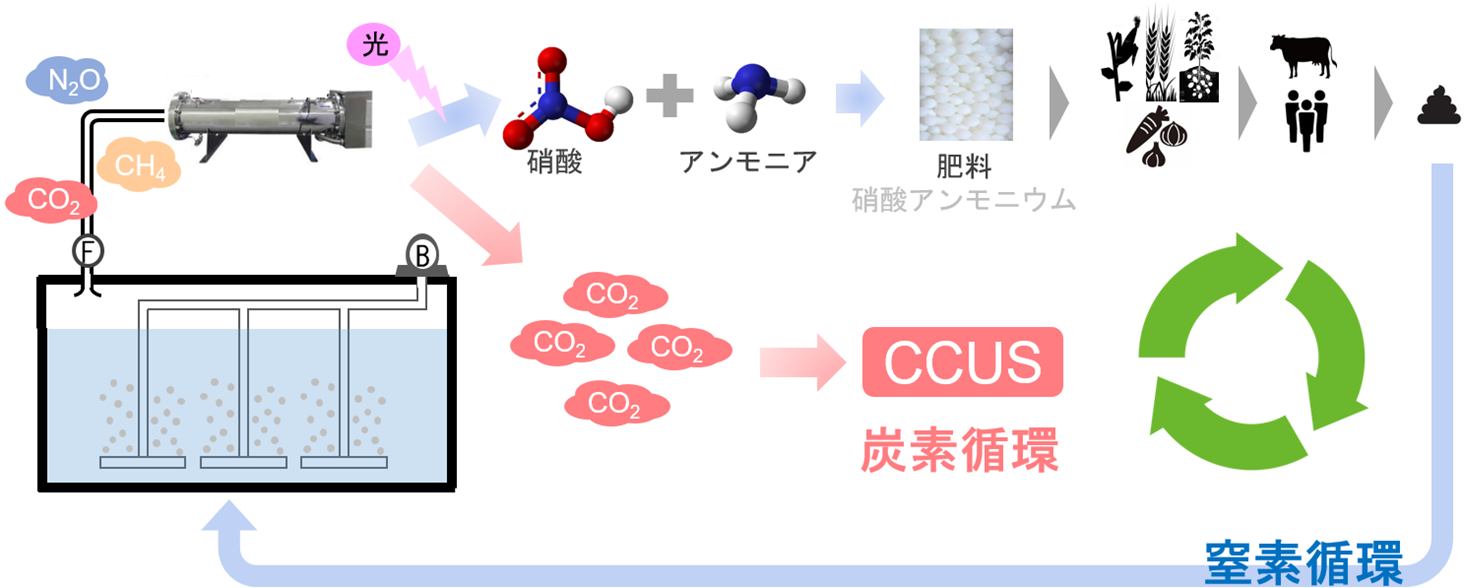
図7 ウシオの目指す循環社会
参考文献
1) 日本国温室効果ガスインベントリ報告書2023年2) R.Atkinson et al., Atmos. Chem. Phys. 4, 1461-1738 (2004); R. Atkinson et al., Atmos. Chem. Phys. 6, 3625-4055 (2006).
3) N.Hishinuma , J. Plasma Fusion Res. Vol.81, No.12, 1012-1015 (2005)
4) 特許第6188085号「硝酸製造方法および硝酸製造装置」
Copyright © USHIO INC. All Rights Reserved
1116
1115
論文を探す
分野・業界
キーワード
掲載誌:ライトエッジ2024

