日本レーザー医学会誌 JJSLSM Vol.27 No.2
原著 ORIGENAL ARTICLE
(2006年7月)
新規水銀ランプを利用した
光線力学的診断用ランプ光源装置
木村 誠1, 2、徳岡由一3、落合 晃3、森 和之1、森本幸裕1、平本立躬1、川島徳道2, 3、金子貞男4
1: ウシオ電機株式会社/〒100-8150東京都千代田区大手町2-6-1
2: 桐蔭横浜大学先端医用工学センター/〒225-8502神奈川県横浜市青葉区鉄町1614
3: 桐蔭横浜大学医用工学部臨床工学科/〒225-8502神奈川県横浜市青葉区鉄町1614
4: 特定医療法人柏葉脳神経外科病院/〒062-8513北海道札幌市豊平区月寒東1条15丁目7番20号
Corresponding author:tokuoka@cc.toin.ac.jp(徳岡 由一)
Abstract
We developed new lamp light sources for photodynamic diagnosis (PDD) and evaluated their optical characterization. The lamp light sources were produced using lamps including mercury gas with and without metal halide such as gallium iodide, potassium iodide, or rubidium iodide into their discharge tube. These lamp light sources are abbreviated as Hg lamp, Ga lamp, K lamp, and Ru lamp. The fluence rate in 405±10 nm of Hg lamp (input power: 150 W) was the greatest among the lamp light sources and was about 10 times as high as that of a xenon lamp light source (input power 300W), which have been used for PDD in medical treatments. Furthermore, the fluorescence intensity of protoporphyrin IX (PpIX) photoexited with Hg lamp was quite larger than that with any other lamps. This tendency was associated with the result from absorption photon energy of PpIX solution for the irradiation light from the lamps. When applying Hg lamp for PDD of a brain tumor in human brain tumor patient's extraction using 5-aminolevulinic acid-induced PpIX, moreover, we could observe red fluorescence emitted only from malignant brain tumor tissues by naked eyes. Consequently, Hg lamp produced in this study may be clinically effective for PDD in malignant brain tumor extraction.
Key words: photodynamic diagnosis, glioblastoma, 5-aminolevulinic acid, protoporphyrin IX, and mercury lamp
要旨
光線力学的診断(PDD)用新規ランプ光源装置の開発を目的に、新たに水銀ランプおよびヨウ化ガリウム、ヨウ化カリウムあるいはヨウ化ルビジウムとを封入したメタルハライドランプを作製し、それらを備えたファイバ型ランプ光源装置(Hg光源装置、Ga光源装置、K光源装置およびRb光源装置)の光学的特性および蛍光発光能を測定するとともに、5-アミノレブリン酸(ALA)を用いた悪性脳腫瘍の摘出術中PDDにおける有用性を評価した。その結果、405±10nmにおける放射照度は、Rb光源装置<K光源装置<Ga光源装置<Hg光源装置であった。このとき、Hg光源装置(電気入力:150W)の放射照度は、既存のPDD用光源装置であるキセノンランプ光源装置(電気入力:300W)の放射照度より約10倍高かった。さらに、プロトポロフィリン IX(PpIX)溶液の蛍光強度を測定したところ、Hg光源装置が最も高い蛍光強度を示し、放射スペクトルとPpIX溶液の紫外‐可視吸収スペクトルとから得られる全光エネルギー吸収度から示唆される結果と一致した。また、Hg光源装置を、ヒト悪性脳腫瘍患者さんの悪性脳腫瘍2症例の摘出術中PDDに応用したところ、悪性脳腫瘍組織から赤色蛍光が観察され、悪性脳腫瘍組織と正常脳組織との肉眼による鑑別が可能であることがわかった。
キーワード:光線力学的診断・悪性脳腫瘍・5-アミノレブリン酸・プロトポルフィリンIX・水銀ランプ
1.緒言
Glioblastomaなどに代表される悪性脳腫瘍の摘出手術では、神経症状を悪化させずにかつ可及的大量に腫瘍組織を摘出することが求められている。しかし、手術前にMRIなどで悪性脳腫瘍の位置を確認するものの、術中に悪性脳腫瘍組織と正常脳組織とを肉眼で鑑別することは難しい。残存腫瘍は患者さんの生命予後に影響を与え、正常脳組織の過剰な摘出は治療後の重篤な機能障害を引き起こす懸念を持つ。したがって、手術を効果的にかつ安全に施行するために、術中に正常組織と腫瘍組織とを容易に鑑別するための診断技術が強く求められていた1)。
近年、そのような要請に対して、悪性脳腫瘍組織と正常脳組織とを術中に診断・鑑別する方法として光線力学的診断(Photodynamic diagnosis; PDD)注1が注目されている2)。PDDとは、悪性腫瘍に親和性を有する蛍光試薬を投与し、腫瘍組織に選択的に蓄積させた後、特定波長の光を照射して発せられる蛍光色を観察することによって、悪性腫瘍部位を特定する診断方法である3)。PDDは簡便で診断時間も短く、さらに生体侵襲性が少ない診断方法として有効である。
現在、悪性腫瘍におけるPDDでは、蛍光試薬としてヘマトポルフィリン誘導体(フォトフリン®)や5-アミノレブリン酸(ALA)が主に用いられている4)。特に、ALAは内因性化合物であるため安全性が高く、代謝・排泄時間が短いことから副作用が少ないなどの特長を持つ。ALAは、それ自体では蛍光発光できないが、外因性のALAが過剰に投与されると、ヘム生合成経路においてヘムの前駆物質であり蛍光発光能を持つポルフィリン系化合物、特にプロトポルフィリンIX(PpIX)を細胞内に蓄積する5,6)。PpIXは、400nm付近にモル吸光係数が大きいSoret帯とよばれる吸収ピークと、500~700nmにモル吸光係数が小さい複数のQ帯とよばれる吸収ピークを持っている。PDDでは、PpIXのSoret帯の吸収ピークを利用して、400nm付近の青色光を照射してPpIXを励起させ、蛍光色である630nm付近の赤色光を観察する4)。
PDD用光源としては、一般に、半導体レーザが用いられている3)。レーザ光源は、放射照度が強くて照射面積が狭いため、組織深部および小面積の精密診断に適している。しかし、診断面積が小さいため腫瘍全体のイメージを一度に捉え難いという問題点がある。そのため、照射面積が広いランプ光源をレーザ光源と相補的に利用することによって、短時間で正確に腫瘍部位を診断・鑑別することができると考えられる。
これまでPDD用ランプ光源装置として、キセノンランプを用いた光源装置が多用されている7-10)。しかし、キセノンランプ光源は、PDDに有効な400nm付近の放射強度が低くいため11)、得られる蛍光強度は微弱である。そのため、高電力化による放射照度の増加が不可欠となり、必然的に装置は大型で高価なものになる。
そこで本研究では、小型でありながら400nm付近に大きな放射照度を有するPDD用新規ランプ光源装置の開発を目的に、新たに水銀ランプおよびメタルハライドランプを作製し、それらを用いたファイバ型ランプ光源装置の光学的特性および蛍光発光能を測定するとともに、ALAを用いた悪性脳腫瘍摘出術中PDDにおける有用性を検証した。
2.実験
2.1 ランプの作製
波長400nm付近の放射強度を増大させるため、水銀ランプおよびメタルハライドランプに注目した。Fig.1にランプの模式図を示す。いずれのランプも形状は同じである。水銀ランプには、照射光の均一化およびファイバ(後述)への光の送り込み効率を向上させるため、超高圧水銀ランプと同様に、電極間距離が短い(4mm)高放射照度ショートアーク型ランプ構造を採用した。さらに、医療機器としての安全性を考慮して、ランプ割れ防止のためにバルブ内のガス圧を10~20気圧に抑えた(これまでの超高圧水銀ランプのガス圧は約30気圧である)。また、メタルハライドランプは、上述の水銀ランプのバルブ内に、400nm付近に強い線スペクトルを放射することができる各種金属ハロゲン化物、すなわちヨウ化ガリウム、ヨウ化カリウムあるいはヨウ化ルビジウムを封入して作製した。それらのランプを、以後、Hgランプ、Gaランプ、KランプおよびRbランプと略す。
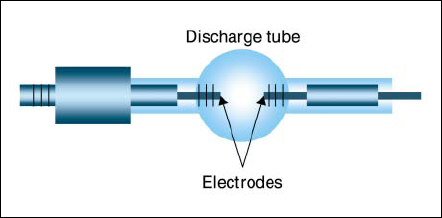
Fig.1 Structure of lamps produced in this study.
2.2 光源装置の作製
ファイバ型ランプ光源装置はウシオ電機社製SUS66 (電気入力:150W)を用いた。ファイバ型ランプ光 源装置の模式図をFig.2に示す。本装置は、光源本体 部とファイバ部とから構成されている。本体部でラ ンプから出た光は、SiO2-TiO2混合多層膜をコーティ ングした楕円ミラー(有効焦点距離:75mm,倍率:8倍)によって集光されファイバ内に導入される。その際、ファイバの入射口前面にバンドパスフィルタ(405±10nm)と熱線カットフィルタとが設置され、不要な波長の光は除去される。ファイバはプラスチック系ファイバで、直径は約10mmである。さらに、照射光の均一化のために、ファイバの照射口にロッド・レンズが設置されている。本光源装置のサイズは、ファイバ部を除いて、289mm×180mm×161mmである。実験では、この光源装置に2.1で作製したランプを設置して用いた。それらのファイバ型ランプ光源装置を、以後、Hg光源装置、Ga光源装置、K光源装置およびRb光源装置と略す。また、キセノンランプ光源装置はZEISS社製 Superlux(電気入力:300W)を用いた。
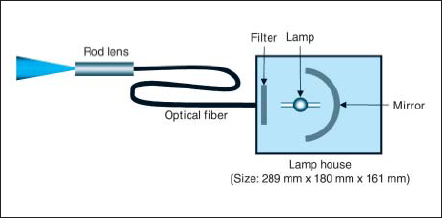
Fig.2 Lamp light source produced in this study.
2.3 光源装置の放射照度測定
ランプ単体の放射照度は、測定距離を1mとして波長分解能が1nmであるモノクロメータ(G250、ニコン社製)をランプに対し水平に取り付けて測定した。また、各光源装置の放射照度は、スペクトロラジオメータ(USR-40D、ウシオ電機社製)および紫外線積算照度計(UIT150/UVD-C405、ウシオ電機社製)を用いて測定した。
2.4 PpIXの蛍光強度測定
PpIX(Aldrich社製)をジメチルスルフォキシド(関東化学社製)に溶解させ、濃度4.5×10-5 mol/lのPpIX溶液を調製し、その蛍光スペクトルを、各ファイバ型ランプ光源装置を用いて励起させ、蛍光分光光度計(FP-6500、日本分光社製)を用いて測定した。
2.5 悪性脳腫瘍摘出術中PDDにおけるファイバ型 ランプ光源装置の有用性評価
悪性脳腫瘍の患者さんに1000mgのALAを麻酔1時間前に経口投与し、手術室へ移動させた。全身麻酔下において開頭術を行い、悪性脳腫瘍が存在すると考えられる手術野にファイバ型ランプ光源装置を用いて励起光を照射し、赤色蛍光発光の有無を目視で観察することによって、悪性脳腫瘍組織と正常脳組織との鑑別を試みた。さらに、切除した赤色蛍光発光している組織の病理組織学的検査を行った。ただし、これらの臨床試験は柏葉脳神経外科病院の倫理委員会で承認され、患者さんの十分なインフォームド・コンセントを得て行われたものである。
3.結果および考察
3.1 ランプ単体およびファイバ型ランプ光源装置の放射スペクトルと放射照度
各ランプ単体の放射スペクトルをFig.3に示す。400nm以上の波長領域に注目すると、Hgランプでは405および436nmにピークが認められた。さらに、Gaランプは、402、408、416、422および435nmに5つのピークを示した。また、KランプおよびRbランプの放射スペクトルは、水銀の放射スペクトルに類似しており、いずれも404および435nmにピークを示した。また、各ランプ単体の波長領域405±10nmにおける放射照度をFig.3から算出した結果をTable 1に示す。ランプ単体の放射照度はRbランプ<Kランプ<Hgラン プ<Gaランプであった。
次に、スペクトロラジオメータを用いて測定した各ファイバ型ランプ光源装置の放射スペクトル(ファイバの出射口から距離:50mm、照射野の直径:45mm)をFig.4に示す。いずれの光源装置においても、照射光の波長領域は405±20nmであった。また、Table 2に、Fig.4の放射スペクトルから算出された405±10nmにおける放射照度を示す。その結果、放射照度はRb光源装置<K光源装置<Ga光源装置<Hg光源装置であった。また、照射野の放射照度の均一度は、いずれの光源装置においても±15%以内であっ た。
Table 1で示した各ランプ単体における放射照度と、Table 2に示したファイバ型ランプ光源装置における放射照度とを比較すると、ランプ単体におけるGaランプの放射照度はHgランプのそれより高いものの、Ga光源装置の放射照度はHg光源装置より低いことが明らかとなった。これはFig.5に示すとおり、Hgランプでは電極間でのアーク放電部が均一(Fig.5 (A))であるのに対し、Gaランプでは両電極付近に輝点が分散(Fig.5 (B))しているため、効率良く集光できなかったためと考えられる。
最も放射照度が高かったHg光源装置と既存のPDD用光源装置であるキセノンランプ光源装置との放射照度を、紫外線積算照度計を用いて測定した。ただし、測定波長領域は405±10nmとし、照射野の直径は10、50および100mmとした。その結果をTable 3に示す。照射野直径10mmで比較すると、Hg光源装置の電力入力はキセノンランプ光源の電気入力より低いものの、Hg光源装置の放射照度はキセノンランプ光源装置の放射照度より約10倍高いことが明らかとなった。また、いずれの光源装置においても照射野の直径が増加するにつれ放射照度は減少するが、Hg光源装置の場合、照射野の直径が100mmでも約2mW/cm2の放射照度が得られた。
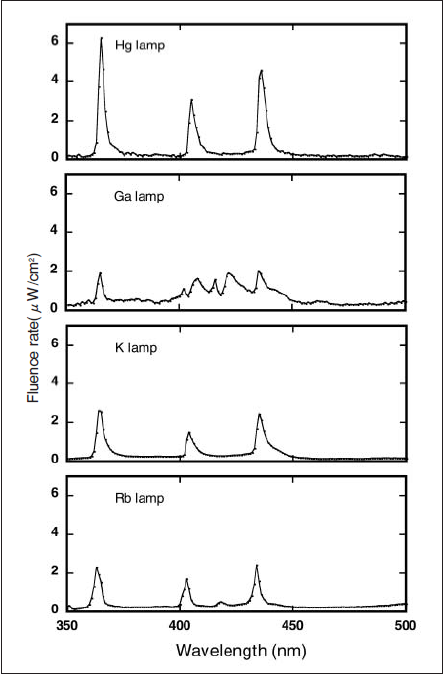
Fig.3 Spectral output of lamps.
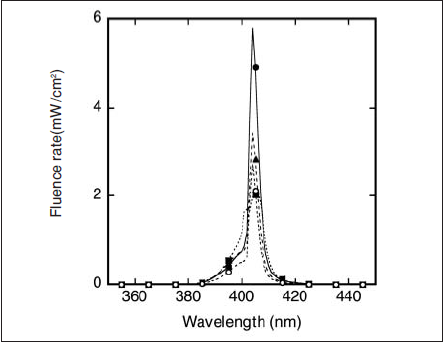
Fig.4 Spectral output of lamp light sources. ●: Hg lamp light source, ■: Ga lamp light source, ▲: K lamp light source, and ○: Rb lamp light source.
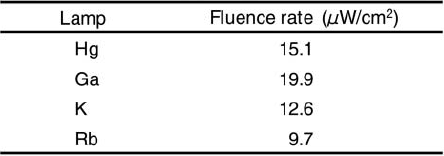
Table 1. Fluence rate of lamps at 405 ±10nm
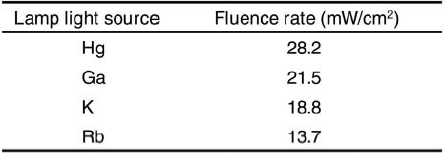
Table 2. Fluence rate of lamp light sources at405 ±10nm

Table 3. Fluence rate of Hg and Xenon lamp light sources

Fig.5 Photographs of discharge tube of Hg (A) and Ge (B) lamps
3.2 ファイバ型ランプ光源装置によるPpIXの蛍光発光と悪性脳腫瘍摘出術中PDD
PpIXの励起に対する各ファイバ型ランプ光源装置の有効性を、全光エネルギー吸収度(absorption photon energy、Eabs)を用いて評価した。Eabsは、化合物に光照射した際、その化合物による光エネルギーの吸収効率を表し、Eabsが大きいほど、照射した光エネルギーが効率よく化合物に吸収されることを意味する。さらにEabsは、波長λにおける光の分光放射照度E(λ)と化合物の分光吸光度Abs(λ)とを用いて次式で表される12)。
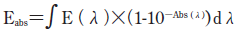
本研究では、Fig.4に示した各ファイバ型ランプ光源装置の放射スペクトルとPpIX可溶化水溶液(2.5×10-5 mol/l)の紫外‐可視吸収スペクトル12)とを用いてEabsを算出した。その結果をTable 4に示す。表から明らかなように、EabsはRb光源装置<K光源装置<Ga光源装置<Hg光源装置の順に高くなり、Hg光源装置がPpIXの励起に対して最も有効であることが示唆された。
さらに、各ファイバ型ランプ光源装置によって励 起されたPpIXの蛍光強度を確認した。蛍光分光光度計にファイバ型ランプ光源装置の光を導入してPpIX溶液に照射し、このときのPpIXの蛍光スペクトルを測定した。ただし、蛍光測定前後におけるPpIX溶液の紫外‐可視吸収スペクトルに差違が認められなかったことから、蛍光測定時におけるPpIXのブリーチングの影響はないと考えられる。Fig.6に得られた蛍光スペクトルを示す。図から明らかなように、各ファイバ型ランプ光源装置において630nm付近にPpIX由来の蛍光ピークが認められ、蛍光強度はRb光源装置<K光源装置<Ga光源装置<Hg光源装置であった。つまり、上述のEabsの結果と合わせて考えると、Hg光源装置による大きい蛍光強度は、Hg光源装置の照射光がPpIXによって効率良く吸収されたためと考えられる。
前項で示した放射照度と蛍光発光強度の一連の結果から、本研究で作製した光源装置の中で、Hg光源装置がPDD用光源装置として最も有効であることが示唆された。そこで、Hg光源装置を用いて悪性脳腫瘍2症例に対して摘出術中PDDを施行した。白色光およびHg光源装置から光照射した際の手術野および切除後の悪性脳腫瘍組織の一例をFig.7に示す。白色光下では、悪性脳腫瘍組織と正常脳組織とを目視で鑑別することは困難であった(Fig.7(A))。しかし、Hg光源装置で光照射した場合(Fig.7(B))、悪性脳腫瘍組織にだけに赤色蛍光発光が認められ、悪性脳腫瘍組織と正常脳組織との目視による鑑別が可能であることがわかった。さらに、切除した赤色蛍光発光している組織(Fig.7(C)および(D))を病理学的に検査したところ、いずれの症例もanaplastic astrocytomaであることがわかった。また、手術翌日にMRI検査を行ったところ、明らかな腫瘍の残存陰影は認められなかった。
以上、悪性脳腫瘍組織2症例において、Hg光源装置は悪性脳腫瘍摘出術中PDDに有効であることが確認された。今後は症例数を増やすとともに、悪性度の異なる腫瘍に対しても施行しながら、Hg光源装置のPDD用光源装置としての有効性を引き続き検証して行く予定である。

Table 4. Absorption photon energy
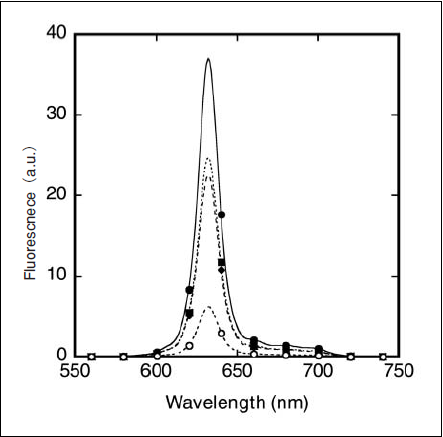
Fig.6 Fluorescence spectra of photoexited PpIX. ●: Hg lamp light source, ■: Ga lamp light source, ▲: K lamp light source, and ○: Rb lamp light source
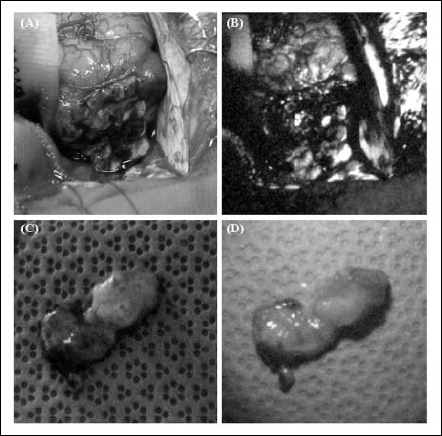
Fig.7 Photographs of malignant brain tumor tissues underwhite light (A and C) and under light emitted from Hg lamp light source (B and D)
4.結言
電極間距離およびガス圧とを制御した新たなHgランプを用いてPDD用Hg光源装置(電気入力:150W、289mm×180mm×161mm)を作製した。Hg光源装置は405±10nmにおける放射照度が強く、PpIXの蛍光発光能も高かった。このとき、この放射照度は、既存のPDD用光源装置であるキセノンランプ光源装置(電気入力:300W)の放射照度よりも高かった。また、Hg光源装置を、ALAを用いた悪性脳腫瘍摘出術中PDDに利用したところ、悪性脳腫瘍組織から赤色蛍光発光が認められ、悪性脳腫瘍組織と正常脳組織とを肉眼で鑑別することが可能であった。
■略 歴

木村 誠(Makoto Kimura)
1986年東京電機大学工学部卒業。同年、ウシオ電機株式会社入社。2005年桐蔭横浜大学大学院工学部博士課程修了。工学博士。現在、桐蔭横浜大学先端医用工学センター研究員およびウシオ電機株式会社技術本部メディカルデバイス部に在籍。医療用光源装置の開発に従事し、高度管理医療機器等販売業責任者を務める。主として、光線力学療法、UV療法などの装置開発に取り組んでいる。2003年度材料技術研究会技術賞。日本光線力学学会、日本レーザー医学会会員等。

徳岡 由一(Yoshikazu Tokuoka)
平成2年東京理科大学理工学研究科工業化学専攻修士課程修了。同年エステー化学株式会社研究部入社。平成8年工学博士(東京理科大学)。平成13年桐蔭横浜大学先端医用センター助手。平成15年桐蔭横浜大学工学部医用工学科専任講師。平成18年より同校医用工学部臨床工学科助教授。現在は、光線力学的療法および診断、並びに生体材料の研究に従事している。平成11年度日本油化学会進歩賞。日本化学会会員、日本セラミック協会会員、日本光線力学学会会員、日本バイオマテリアル学会会員等。

落合 晃(Akira Ochiai)
1991年北海道薬科大学大学院修了。生化学工業株式会社に所属中、聖マリアンナ医科大学 難病治療研究センターへ国内留学し、DDS製剤の研究に従事(医学博士)。2002年に生化学工業を退職し、ミシシッピ大学メディカルセンターにResearch associateとして留学。桐蔭横浜大学先端医用工学センター助手を経て2005年4月より同大医用工学部専任講師。現在、新規医療材料に関する研究を行っている。

森 和之(Kazuyuki Mori)
1968年2月2日生。1990年大阪電気通信大学電子機械工学科卒。同年ウシオ電機(株)入社、現在に至る。一貫してメタルハライドランプや水銀ランプ等の放電ランプの開発に従事。

森本 幸裕(Yukihiro Morimoto)
1986年関西大学工学部応用化学科卒、同年ウシオ電機株式会社技術研究所入社
1995年Vanderbilt大学大学院応用科学科(Applied Science)修士課程修了。1998年より株式会社ウシオ総合技術研究所にて非線形光学結晶育成技術開発に従事。1999年工学博士(東京工業大学総合理工学研究科物質科学創造専攻)。現在、ウシオ電機株式会社R&Dセンター基礎技術推進室ゼネラルマネージャー。ランプとそのアプリ開発、ランプ材料の研究に従事。

平本 立躬(Tatsumi Hiramoto)
1957年京都大学理学部卒。同年旧通産省工業技術院入所。1960年日本原子力研究所(JAERI)に転じ1964年「非平衡プラズマの特性」で理学博士。1967年から69年までドイツKFA Juelich GmbHに勤務。1972年ウシオ電機(株)へ移る。主としてその時々の先端産業の立ち上げ・発展に寄与する光源及び、その応用の開発を行った。2000年ウシオ電機役員退任、現在同社顧問。

川島 徳道(Norimichi Kawashima)
1977年東京理大大学院博士修了。理学博士。現在、桐蔭横浜大学医用工学部臨床工学科教授。研究分野は医用材料、医用センサ、医用治療機器。活性酸素発生装置、河川の浄化、酸素センサ、ドライケミカルセンサ、バイオセラミックス、精密研磨工具、癌の光診断・光治療装置、光造形法を用いた手術シミュレーション用実体モデルの作製等の研究に従事。色材協会論文賞・技術賞、材料技術研究協会論文賞・技術賞受賞。

金子 貞男(Sadao Kaneko)
1970年北海道大学医学部卒業後、北大脳神経外科学講座入局。米国オハイオ州立大学に留学後、1984年北海道大学医学部脳神経外科講師、1985年岩見沢市立総合病院・脳神経外科医長、1997年岩見沢市立高等看護学院学院長、2002年岩見沢市立総合病院副院長を経て、2003年柏葉脳神経外科病院院長に就任。日本脳神経外科学会専門医。日本レーザー医学会評議員・指導医。


