光技術情報誌「ライトエッジ」No.31(2008年10月発行)
月刊「光アライアンス」 日本工業出版社2007年7月
(2008年10月)
光線力学診断および治療における
放電ランプの応用
ウシオ電機株式会社1),桐蔭横浜大学2)
木村誠1)2), 川島徳道2)
はじめに
現在の医療において、痛みや副作用が少なく、臓器の温存が可能であり、患者のQuality of Life (QOL)”、の向上に有効な医療が求められている。そのため、光・放射線・熱などを用いた新しい診断・治療方法が注目されている。これらの診断・治療方法は、①低侵襲であるため患者への負担が少ないこと、②治療が簡単なため専門性の高い特殊技能が不要なこと、③薬の副作用が少ないことなどの特長がある。なかでも光を用いた診断・治療方法は、レーザの出現と光通信技術の進歩により、レーザメスや血液分析機器、タンパク質等の蛍光分析機器をはじめ、医療分野に広く用いられるようになってきた。
光を用いた診断・治療方法のーつに癌の光線力学診断(PDD)および治療(PDT)がある。PDDおよびPDTとは、腫蕩親和性のある光感受性物質を生体に投与したのち、病巣に光を照射し、癌細胞のみを蛍光発光させて判断する方法がPDDであり、さらに癌細胞のみを選択的に破壊する治療法がPDTである。
PDDおよびPDTでは、光源としてレーザ光が主に用いられている。これは、生体内部に光りを送る際、内視鏡などに使用されている細径のファイバに光を効率良く入射することができ、十分な照射エネルギーを確保しやすいためである。また、波長も単一波長であることから時間による照射エネルギー測定が容易に行えることや、照射面積が小さいため毛細血管などの小さな病巣の治療には適していることなどの理由も挙げられる。
一方、レーザ光を用いたPDDおよびPDTには次のような幾つかの問題点がある。
- ● ビーム径が小さいため、診断や治療の面積が小さい
- ● 単一波長のため、診断と治療が別々のシステムで行わなくてはならない
- ● 管理者や装置のための特別な設備を必要とする
- ● 装置が大規模である
- ● メンテナンスが難しい
- ● レーザ光を謝って正常組織に照射した場合、エネルギー密度が高いため大きなダメージを与える
われわれはこれまで、治療面積がレーザより大きく、広範囲に照射が可能な放電ランプを用いたPDT用光源装置の開発に取り組んできた。本稿では、PDDおよび PDTについて概説するとともに、われわれが開発した放電ランプを用いたPDT光源装置について説明する。
2. PDDとPDT
2.1 PDDとPDTの原理
PDDとは、癌細胞に集積にされやすく、単独では細胞毒性を有しない特殊な光感受性物質(あるいは光感受性物質の前駆体物質)を投与して癌組織に選択的に蓄積させ、特定波長の光を照射することによる発光現象を利用した診断である。またPDTとは、組織内部での光感受性物質の光化学反応によって生成する活性酸素種あるいはラジカル種を細胞毒として利用して、癌組織のみを選択的に壊死させる治療方法である [1,2]。
具体的には、図1 に示すように、生体内に光感受性物質を服用・注射・塗布することにより投与する。癌細胞と正常細胞とにおける光感受性物質の吸収・代謝時間が異なることを利用して、光感受性物質を癌細胞のみに蓄積された状態で光を照射する。光励起された光感受性物質(励起一重項状態)は非常に不安定であるため、安定した状態に成るべく、一部が基底状態に戻る。この際に発せられる光(蛍光)の有無を目視または顕微鏡や内視鏡を用いて観察して診断を行うにのような診断方法がPDDである。
また、光感受性物質が励起一重項状態から項間交差を経て励起三重項状態となり、さらに励起三重項状態から基底状態へ戻る間に、生体内の溶存酸素にエネルギーを転換したり、光酸素化反応を経て生成したフリーラジカル種が溶存酸素と反応したりして、活性酸素種であるヒドロキシラジカル、一重項酸素、過酸化水素、スーパーオキシドなどを生成し、癌細胞に傷害を与える。この原理に基づいた治療方法がPDTである [3]。
特にPDTは、従来の外科的な手術とは異なり、痛みや副作用が少なく、臓器の温存が可能であり、患者の "Quality of Life (QOL)',の向上に有効な治療法であり、多くの医療分野で利用されている。例えば、1993年カナダで、光感受性物質のーつであるフォトフリンによる勝脱癌の治療が世界で初めて承認され、1994年オランダにて肺癌、食道癌の治療、その後1995年アメリカで食道癌の治療が認可を受けている [4]。本邦でも早期肺癌、表在型食道癌、表在型早期胃癌、子宮頚部初期癌およびその異形成や黄色斑変性症に対するPDTが、現在、厚生労働省の認証を受けている [5]。
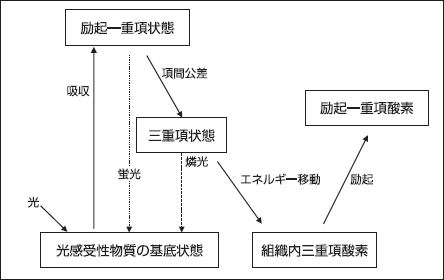
図1.光感受性物質の光化学作用
2.2光源
PDDを行う場合、①光感受性物質の吸収波長に相当する350-450nmの光であること、②正常組織に悪影響を及ぼさない可視光、または可能な限り可視光側の UV-Aであること、③UV光によって正常組織が自家蛍光を発しないこと、④出力光が蛍光(燐光)とクロストークしないことなどから、390〜410nmの光が望ましい。ただし、現在では目視検査だけでなく、画像処理技術が導入されているため、光感受性物質の他の励起波長を用いた研究も行われている。
またPDTにおいて用いられる光は、①組織表面や血液成分に吸収され難い600nm以上の波長を有する必要がある。また、②照射中に組織に対して熱傷を起こさないこと、③光化学反応によって一重項酸素が生成するのに必要なフオトンエネルギーを有する必要があることを考慮すると、800nm以下の光である必要がある。つまり、 PDTに禾U用させる光の波長は600-800nmに限定される [6]。
PDT用ランプ光源装置としては、現在国内で光線力学療法用として、厚生労働省の認証を受けている装置はない。しかし、欧州では薬剤と装置の許認可が別々に行われていることから、すでにPDT用光源装置として、ハロゲンランプ、キセノンランプ、蛍光ランプを用いた治療装置が商品化されている [7-9]。
ハロゲンランプは、その出力の90%が赤外光領域にあるため、PDTに必要な600~800nmの成分は少なく、500~1000wの高出力ランプが用いられている。電源が不要なことやコストパフオーマンスが良いことなどの特長があるが、装置の冷却や照射患部の冷却が必要となるなどの短所もある。また、キセノンランプも同様で、出力波長がブロードな上、赤外光領域に強い輝線を持っているため、冷却が必要となる。さらに、フィルタ等でカットしても発熱を伴う放射光の一部が直接患部に照射され患者に熱感を与えるといった問題がある。さらには、これらランプを使用して治療器を作製する場合、発熱量が高く、冷却用のフアンや放熱フィンなどの熱対策はもとより、装置が大型化するためコストや装置サイズの問題点も抱えている。また蛍光ランプでは、電極間が広いため、放射エネルギーが低く、不要な場所(正常組織)にも照射してしまうという問題がある。
一方、メタルハライドランプは高圧水銀蒸気中に種々の金属ハロゲン化物(メタルハライド)を添加した高圧放電ランプであり、添加する金属元素が多様に選べるために非常に変化に富んだ放電ランプが得られる。
メタルハライドランプに封入される金属ハロゲン化物は、発光特性によって、大きく2種に大別される。一つは少数の強力なスペクトル線を発光する金属ハロゲン化物であり、もうーつは可視領域で連続的な分光分布を発光する金属ハロゲン化物である。さらに後者は、連続的に分布した多数のスペクトル線を発光するものと、連続スペクトルを発光するものとがある。また、発光させることが目的でなく、アークの安定や他の金属ハロゲン化物の発光を助長する目的で封入される物質もある。ハロゲン元素としてはョウ素と臭素が使用され、塩素とフッ素は反応性が強すぎるため一般には使用されない。
上述したPDDおよびPDTに用いられる光の波長を考慮し、PDDおよびPDTに用いることが可能な金属元素を表1に示す。われわれはこれまで、表1中の数種類の金属を選択し、PDDおよびPDT専用ランプを作製してきた。
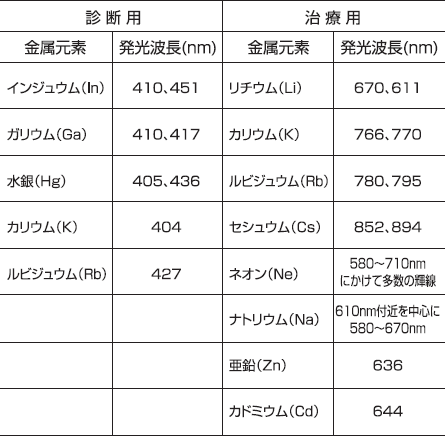
表1 . PDDおよびPDTに利用可能な金属元素
2.3 光感受性物質
PDDおよびPDTでは、光感受性物質の癌組織および新生血管への特異的な集積性と、その蛍光発光あるいは光励起による活性酸素種の生成を利用することを先に述べた。光増感作用を有する化合物は多数あるが、安全性を考慮し生体内に投与できるものは少ない。PDDおよびPDTに多用されている光感受性物質の一つにポルフイリン系化合物がある。ポルフイリン系化合物は四つのピロールがメチン(-CH=)基で結合した環状化合物で、植物界ではクロロフィルに代表され、動物界では血液中の酸素を運ぶヘモグロビンの基本骨格となっている。ポルフイリン系化合物は、共役系による冗電子の非局在化に伴い、可視光領域に強い吸収を持っている。また、PDTに用いられる光感受性物質としては、ポルフイリン系化合物以外に、還元ピロールを一つ有するクロリン系化合物、二つの向かい合う還元ピロールを有するバクテリオクロリン系化合物、また合成ポルフイリンとしてフタロシアニン系化合物が用いられている。
現在、国内で認可を受けている癌治療PDT用光感受性物質はヘマトポルフイリン誘導体(HpD、フォトフリン®)は、1ケ月以上遮光生活を強いられ、副作用の日光皮膚炎の報告例が多いことから [10,11]、治療・診断後、暗室の生活を余儀なくされる。さらに、低悪性度の癌への適用は制限されるなどの欠点もある。これらの問題を解決すべく1990年代に入ると第二世代の光感受性物質の研究が開始され、1990年にKennedyらが、代謝時間の短い(約3日程度)δーアミノレヴリン酸(5-ALA)を発表し、局所塗布による基底細胞癌に対してPDTの治療成績が発表された [6]。その後、クロリン系化合物であるNPe6(mono-L-aspartyl chiorin e6) [12]、 ATX-S10 (Na) (gallium-porphyrin complex) [13]などの製品開発が行われ、多くの光感受性物質が研究されている。
5-ALAはそれ自体には光感受性はない。また、ヘム生合成経路におけるポルフイリンの前駆物質である。生理的には一定量のヘムの産生されるとネガティブフィードバック機構によって5-ALAの生合成が阻害されるが、過剰な外因性の5-ALAが与えられると、ネガティブフィードバック機構が効かなくなり、ヘム生合成における律速酵素であるフエロキラターゼが枯渇し、生体内因性ポルフイリン化合物、特にプロトポルフイ1) ンIX (PpIX)が細胞内に多量に蓄積される。このPpIXを光増感物質として利用する。
PpIXの吸光スペクトルを図2に示す。PpIX は410nm に吸光係数が大きい吸収ピークがあり、他に510nm、 545nm、 580nmおよび630nmに小さいピークがある。診断では主に410nm付近の光が用いられ、治療には 630nmの光が利用されている [14]。
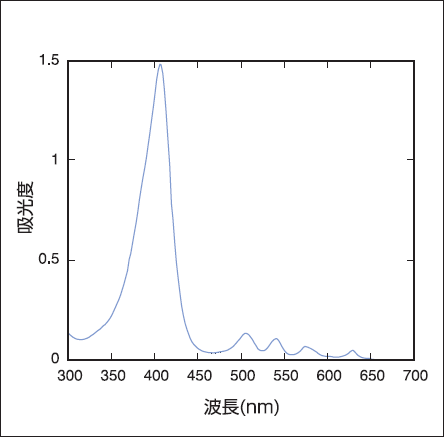
図2. ProtoporphyrinIXの吸光度分布図
3. メタルハライド放電ランプの作製とPDDおよびPDT効果
全照射面における放射スペクトルの強度と均一性とを考慮して、ランプの陰極と陽極との間のアーク長が短い高放射強度のショートアーク型放電ランプを作製した。
PDD用放電ランプは、5-ALAの誘導体であるPpIXの吸収スペクトルに合わせ、波長400~450nm付近の強いスペクトルを放射できるように、水銀と金属ハロゲン化物、すなわちョウ化ガリウム、ョウ化カリウムあるいはョウ化ルビジウムをバルブ内に封入した。また、水銀のみ封入したランプも作製した。また、PDT用放電ランプでは、630nm付近の吸収スペクトルに合わせ、バルブ中に水銀と金属ハロゲン化物、すなわちョウ化ナトリウム、ョウ化リチウム、ョウ化カリウム、ョウ化ルビジウムあるいはョウ化ナトリウムとョウ化リチウムの混合物を添加したランプを作製した。
作製した放電ランプを用いて、PDDにおいては、プロトポルフイリンIxの蛍光発光強度の評価実験を行い、 PDTにおいては、ALAを用いた癌細胞のin vitroにおける殺細胞実験を行った。その結果を図3および図4に示す。PDD用放電ランプでは、図3から明らかなように、 Hgランプが最も高い蛍光発光能を示した [15]。次にPDT 用放電ランプでは、図4の通り、Na-Liランプが最も高い殺癌細胞効果を示した [16]。
本放電ランプを実用化に際して、ランプから出た光を集光し、効率良く光学系に送り込むため、可視光を反射し、熱線および紫外線を透過するSiO2;-TiO2;混合多層膜をコーテイングした楕円ミラー(有効焦点距離:75mm,倍率:8倍)を設置した。また、放電ランプの放射強度は、ランプの内部温度に依存するので、内部温度変化を抑制するため、ランプとミラーとを一体化し、ミラー前面にカバーガラスを取り付けた。また、カバーガラスの取り付けによって、万一のランプの破裂に対する安全性も向上した。
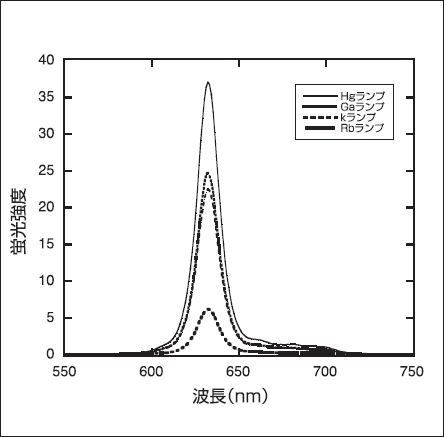
図3.各PDD用放電ランプをPpIXに放射したときの蛍光強度
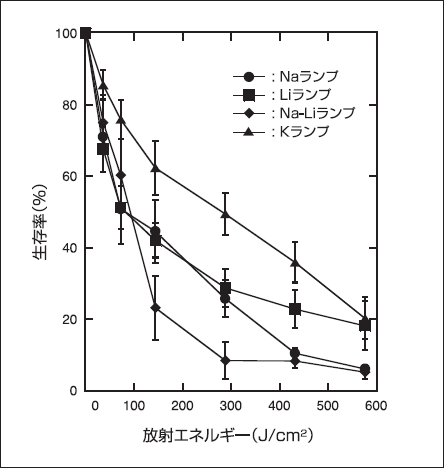
図4.各PDT用放電ランプを癌細胞に放射したときの殺細胞効果
4. PDDおよびPDT用放電ランプ装置「セラビーム®VRJ
作製したメタルハライド放電ランプを用いてPDDおよびPDT用光源装置の開発を行った。光源装置を設計する際、皮膚科および形成外科領域での利用を考慮し、最大照射面を直径100mm程度の円形とした。そして操作性向上のために、2006年に赤外線治療器として薬事認可を得て発売している「セラビーム®VR630」をベースに、フィルタ交換可能な「セラビーム®VR」[15]を開発した。図5に実際に作製した直射型光源装置の全体写真を示す。
学系は全照射面に対する放射光の均一化を考慮して、ランプの輝点を対物レンズに結像させるケーラー照明法を採用した。また、視野絞りで迷光をカットし、コンデンサレンズ絞りで焦点深度が制御できるようにした。また、本装置はランプおよびフィルタを交換することでPDDおよびPDT用として用いることが可能である。すなわち、PDD用としてはHgランプ、UVカットフィルタおよび熱線カットフィルタを用い、PDT用としてはNa-Liランプ、600~800nm付近の光を透過するバンドパスフィルタおよび熱線カットフィルタを用いる。
図5.セラビーム®VRの全体写真
5. おわりに
すでに「セラビーム®VR」を用いて、PDDでは脳腫蕩の診断臨床 [16]、 PDTでは日光角化症 [17]、 Bowenoid Papu1osis [18]および重度の尋常性ざ癒 [19]の治療臨床を実施しており、近い将来、PDTおよびPDDの機器として薬事認可が得られるように研究開発を進行中である。
筆者紹介
- 木村誠(Makoto Kimura)
- 1986年東京電機大学工学部卒業。同年、ウシオ電機株式会社入社。2005年桐蔭横浜大学大学院工学部博士課程修了。工学博士。現在、桐蔭横浜大学医用工学部研究員およびウシオ電機株式会社技術本部メディカルデノベイス部に在籍。医療用光源装置の開発に従事し、高度管理医療機器等販売業責任者を務める。主として、光線力学療法、UV療法などの装置開発に取り組んでいる。2003年度材料技術研究会技術賞。日本光線力学学会、日本レーザー医学会会員等。
- 川島徳道(NorimiChi Kawashima)
- 1977年東京理大大学院博士修了。理学博士。現在、桐蔭横浜大学医用工学部臨床工学科教授。研究分野は医用材料、医用センサ、医用治療機器。活性酸素発生装置、河の浄化、酸素センサ、ドライケミカルセンサ、バイオセラミックス、精密研磨工具、癌の光診断・光治療装置、光造形法を用いた手術シミユレーション用実体モ刃レの作製等の研究に従事。色材協会論文賞・技術賞、材料技術研究協会論文賞・技術賞受賞。
- ウシオ電機株式会社
- 〒100-8150 東京都千代田区大手町2-6-1
Tel:03-3242-0694 Fax:03-3242-2700 - 桐蔭横浜大学
- 9225-8502神割II県横浜市青葉区鉄町1614
Tel: 045-972-5881


