光技術情報誌「ライトエッジ」No.31(2008年10月発行)
Visual Dermatology
(2008年7月)
皮膚科領域での光線力学治療における
光増感性物質と光源装置
木村誠1,徳岡由一2
1:桐蔭横浜大学先端医用工学センター・ 2:桐蔭横浜大学医用工学部臨床工学科
1.はじめに
光を用いた治療法の一つに光線力学治療 (Photodynamic therapy、PDT)がある。PDTとは、病巣組織に親和性のある光増感性物質を生体内に投与した後、可視光線を照射し組織内で生成した活性酸素種を用いて、病巣組織のみを選択的に破壊する治療法である[1,2]。近年、皮膚科分野では、PDTは日光角化症[3]、Bowen病[4]、Paget病[5]など腫瘍性病変や、重度の尋常性ざ瘡[6-9]、脂線増殖症[10]、難治性疣贅[11]などの治療に用いられており、大学病院だけでなく、クリニックにも普及されつつある。
本稿では、皮膚科分野におけるPDTで用いられている光増感性物質について概説し、重度の尋常性ざ瘡、脂線増殖症などのPDTにおける光照射時の留意点を工学的観点から述べると伴に、広範囲の皮膚組織に一度に光照射ができるPDT用光源装置について紹介する。
2.光増感性物質
光増感作用を有する化合物は多数あるが、安全性を考慮して生体内に投与できるものは少ない。PDTに多用されている光増感性物質の一つにポルフィリン系化合物(図1)がある。ポルフィリン系化合物は、四つのピロール環がメチン基(-CH=)で結合された環状化合物(テトラピロール環)で、植物界ではクロロフィルに代表され、動物界では赤血球中の酸素を運ぶへモグロビンの基本骨格となっている。ポルフィリン系化合物は、共役系∏電子の非局在化に伴い可視光領域に強い吸収を持っている。またポルフィリン系化合物以外にも、還元ピロール環を一つ有するクロリン系化合物、二つの向かい合う還元ピロール環を有するバクテリオクロリン系化合物、あるいは合成ポルフィリンとしてフタロシアニン系化合物(図1)などがPDT用光増感性物質として利用されている。
現在、国内で認可を受けている癌治療PDT用光増感性物質であるへマトポルフィリン誘導体(HpD、フォトフリン®)は代謝速度が小さいため、副作用として日光皮膚炎の報告例が多い[12,13]。そのため、施行後1ヶ月以上の暗所での生活を余儀なくされる。さらに、低悪性度の早期癌にしか適用することができない。これらの問題を解決すべく、1990年代に入ると第二世代の光増感性物質の研究が開始された。1990年にKennedyらが、代謝時間の短いδ-アミノレブリン酸(ALA、図1)を用いた局所塗布による基底細胞癌に対するPDTにおいて、高い治療成績を発表した[14]のを機に、皮膚科分野ではALAが主に用いられるようになった。
ALAはヘム生合成経路においてポルフィリン系化合物の前駆物質であり、それ自体には光増感性はない。生理的には一定量のヘムが産生されるとネガティブ・フィードバック機構によってALAの生合成が阻害される。しかし外因性のALAが過剰に投与されると、ネガティブ・フィードバック機構が無効となり、ヘム生合成における律速酵素であるフェロキラターゼが枯渴して、生体内因性のボルフィリン系化合物、特にプロトポルフィリンK(PpIX、図1)が細胞内に多量に蓄積される。ALAを用いたPDTにおいては、このPpIXを光増感性物質として利用する。
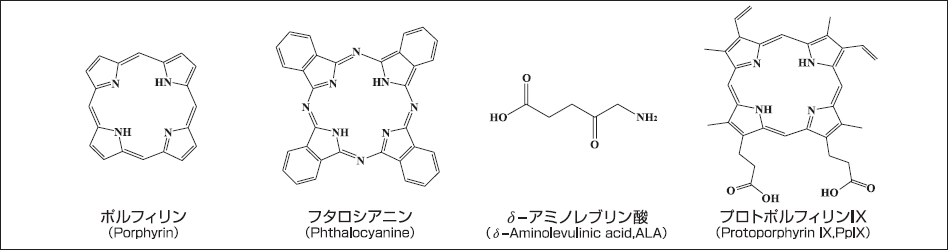
図1. PDTで用いられている光増感性物質の一例
3. ALAの実施例
先にも述べた通り、皮虜科分野ではALAがPDT用光増感性物質として多用されている。ただし、2008年2月現在、ALAは国内薬事認可を受けていないため、ALA の使用に際しては、倫理委員会での承認と被験者に対する十分なインフォームド.コンセントを得る必要がある。
外用ALAを用いたPDTの一連の流れを図4に示す。光照射前にALAを添加した親水軟膏を患部に塗布し ((①))、Tegaderm®などでODT(occlusive dressing technique)を施し(②および③)、患部を遮光しながら所定時間ALAを塗布する(④)。さらに、アイガードで眼を保護しながら(⑤)、所定のエネルギーの光を照射する(⑥)。ここで、ALAの投与量、投与方法、ODT時間、照射エネルギーおよび照射回数は疾患によって異なる。種々の疾患に対する実績値を表1示す。
腫瘍性病変では、親水性軟膏を用いて調製した 20wt%ALA外用薬を病変部に塗布する方法が主に用いられている。光照射4時間前に病巣部に20wt%5-ALA外用薬を塗布し、ODTを行い、50〜100J/cm2で光照射を行う。
重度の尋常性ざ瘡では、正常組織に残存するPpIX 量を少なくする目的で、腫瘍性病変より低濃度の2wt% ALA外用薬を病巣部に外用する。また、ODT時間も1時間程度で、光照射エネルギーも15〜30J/cm2と低い。 すなわち、正常組織へ影響を少なくし、患者への負担を減らす「ソフトなPDT」である。
また重度の尋常性ざ瘡および脂線増殖症においては、ALAを10 mg/kg B.W経口投与する方法も用いられている。10mg/kg B.WのALAを光照射4時間前に内服させて、顔部ならば20〜30 J/cm2、体部ならば50〜 60 J/cm2で光照射を行う。
外用においても経口投与においても、僅かながらではあるが、副作用が懸念される。外用の場合は正常皮膚組織へのPpIXの蓄積に伴う紅斑が懸念される[15]。そのため施行後の遮光管理は重要である。また経口投与の場合は、吐き気や一時的な肝機能障害[8]も認められている。詳細に関しては文献を參照にされたい。
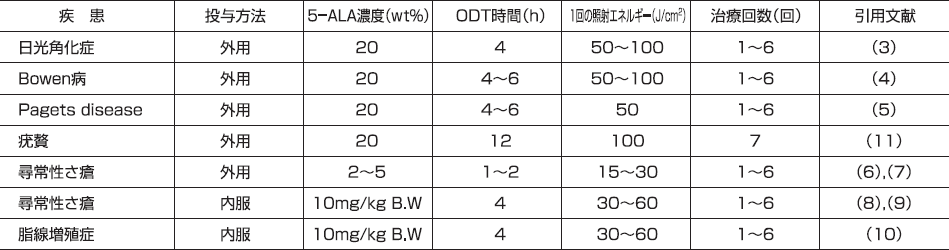
表1.各疾患におけるプロトコール
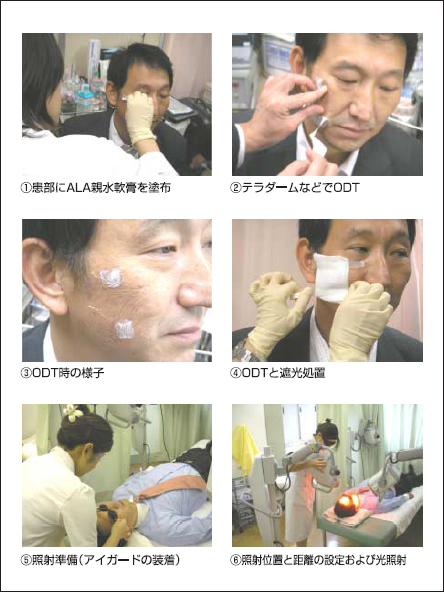
図4. 外用ALAを用いたPDTの実施例
4. 光源装置
一般にPDTでは波長600〜800nmの赤色光が用いられている。一方、PpIXの吸光スペクトル(図2)を見てみると、410nmに吸光係数が大きい吸収ビーク(Soret帯)があり、他に510、545、580およぴ60nmに小さいピーク (Q帯)がある。このことは、PpIXの光励起には波長 400nm付近の青色光が有利であることを示す。しかし図3に示すとおり、長波長の光の方が皮膚組織中への深達度が大きい。また、波長600nm付近の励起光は深度の大きい皮膚組織中に存在するPpIXを効率良く光励起することができる[16]。換言すれば、表在性の皮膚疾患に対しては波長400nm付近の光が有効であり、深部の疾患には対しては600nm付近の光が有効である[17]。
さて、そのような赤色光を照射する光源装置として、レーザ光源が主に用いられている。レーザ光源は、生体内部に照射する際、内視鏡などに使用されている細径のファイバに光を効率良く入射することができ、十分な照射エネルギーを確保しやすい。また、波長も単一波長であることから時間による照射エネルギー制御が容 易に行えること、照射面積が小さいため毛細血管などの小さな病巣部の治療にも適していることなどもレーザ光源が主流になった理由である。具体的には、アルゴンダイレーザ[18]、XeClエキシマレーザを励起光とした波長630nmの色素レーザ[19]、パルス波エキシマダイ・レーザ[20]、波長可変YAG-OPOレーザ[21]、半導体レーザ[22]などが用いられており、特に、エキシマレーザ励起ダイレーザ、波長可変YAG-OPOレーザ(現在では販売中止) および半導体レーザが厚生労働省の認証を受けている。
一方、皮膚科分野では広範囲な病巣部の治療が必要なため、照射面積が小さいレーザ光源では光照射に時間がかかる。さらに、レーザ光源装置は、管理者や特別な施設を必要とすること、装置が大規模であること、メンテナンスが難しいことなどの問題点もある。そのため、大学病院などではエキシマレーザ励起ダイレーザなどのレーザ光源が用いられているが、クリニックなどではランプ光源が主流である。
現在国内で上市され、且つ、PDTに適応可能な光源装置の一例を表2に示す。さらに、薬事認可を受けている光源装置の写真を図5に掲載する。
現在PDT用として厚生労働省の認可を受けているランプ光源装置はない。欧州では、ハロゲンランプ、キセノンランプ、照明用メタルハライドランプ、蛍光ランプ、 LEDなどがPDT用ランプ光源装置として上市されている[23-25]。また本邦でも、赤外線治療器として薬事認可された治療器がPDTに流用されている。
ハロゲンランプは、特殊な安定器が不要なこと、コストパフォーマンスが良いことなどの特長がある。しかし、照射光の90%が赤外光領域にあるため、PDTに必要な波長600〜800nmの光成分は少ない。ハロゲンランプを設置したプロジェクタなどを光源として用いた際に PDT効果が低いのはこのためである。そこで高出力化による治療効果の向上が必要とされるが、必然的に装置や照射患部の冷却などが必要となるなどの問題点が発生する。
キセノンランプや照明用メタルハライドランプも、出力波長がブロードで、赤外光領域に強い輝線を持つ。このため、そのままの状態では患者に感熱を与えてしまう。そこで波長600〜800nmのバンドバス・フイルタに交換などして、感熱を低下させる工夫がなされている。しかしフィルタを交換しても発熱を伴う放射光の一部が直接に病巣部に照射されてしまうことがしばしば確認されている。近年、これらの問題を解決するため、金属ハロゲン化物をバルブ内に封入し、PDTに必要な波長 600〜800nmの光を効率よく放射できる専用メタルハライドランプが開発.上市されている(図6)[26]。
蛍光ランプは、コストパフォーマンスが高く、発熱も大変少ないという利点がある。しかし、波長600〜800nmの赤色光の光変換効率(電力を光に変換するときの効率)が低いため、専ら光変換効率の高い波長400〜500nmの青色光用光源装置として用いられている。先に述べた通り、青色光は皮膚の浸透性が低く、皮膚表層部位にしか届かないため、深部の治療には有効ではない。さらにランプ1個当たりの照射エネルギーは小さいため、十分な照射エネルギーを得るためには、複数のランプを並列で使用する必要があり、光照射不要な部位(正常組織)にも光が当たってしまうなどの短所もある。そのため、利用はALA外用による日光角化症などの表在性疾患の治療に限定される。
LEDはランプ光とは異なり光変換効率が高く、寿命も長いため、有望な治療器として期待されている。現在上市されているLED光源装置は、LED1個当たりの照射エネルギーが低いため、数十から数百個のLEDを単純に並べて使用されている。このため、蛍光ランプと同様に、照射面積の制御が難しく、光照射不要な場所(正常組織)にも照射してしまう。さらに中心照度が高いため、照射面の中心に過剰な光が照射されて潰瘍ができたり、疾病周辺部では逆に、照射量不足によって再発したりするという問題も報告されている。しかし、今後LED1個当たりの照度が増加し、光学系が改善されれば、PDTには大変有効な光源に成りうるであろう。
上述の通り、現在、PDT用として薬事認可を取得したランプ光源装置はない。そのため、美容機器などとして上市された光源装置をPDTに流用する場合が多い。しかし薬事認可を受けていない光源装置の中には、PDT に適切な波長ではないもの、照射均一度が低いもの、回路や素子の熱処理が施されていないもの、ノイズ処理が成されていないものなどが見受けられ、トラブルの発生が危惧される。少なくとも薬事認可された光源装置を使用すべきである。
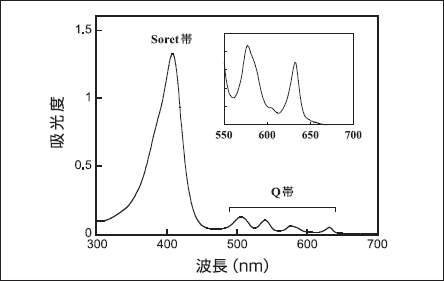
図2. PpIXの光吸収スペクトル
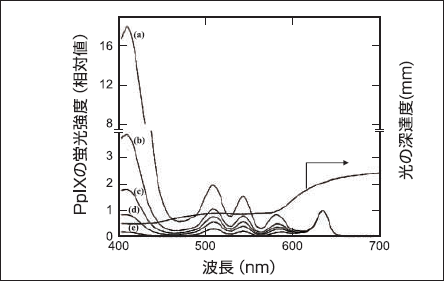
図3. 励起光の皮膚組織深達度と深度の異なる皮膚組織中のPpIXからの 690nmにおける蛍光強度(ただし、縦軸は635nmにおける蛍光強度を基準とした相対値、横軸は励起光波長) 皮膚表面からの深度(a):0.0 mm、(b):1.0 mm、(c):1.5 mm、(d):2.0 mm、(e):3.0 mm
図5. 国内で薬事認可を受けている治療機器
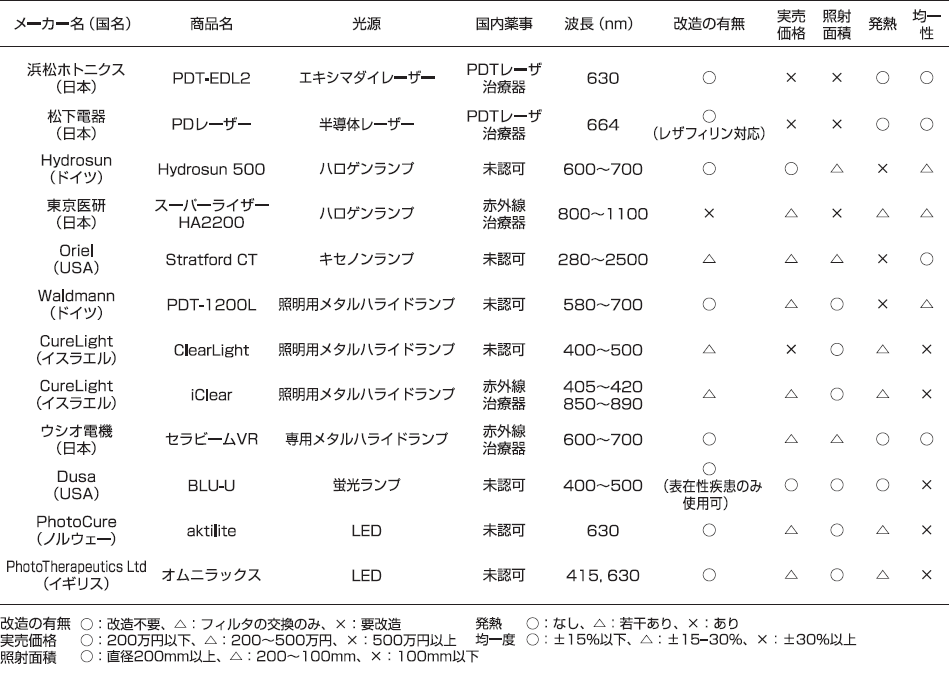
表2. PDTに使用可能怒装置一覧
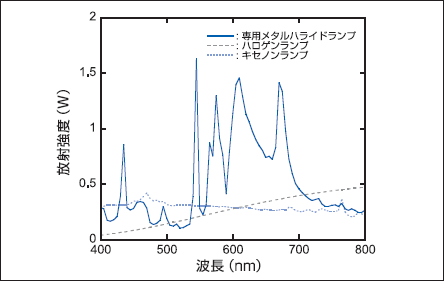
図6. 電力150Wのキセノンランプ、ハロゲンランプおよび専用メタルランプの放射スペクトル
5. おわりに
本稿ではPDTにおける光増感性物質と光源装置について、皮膚科分野に特化して概説した。光増感性物質に関してはALAを中心に、クリニックなどでも導入しやすいように、種々の皮膚疾病に対するALA濃度、 ALA塗布後から照射までの時間、照射エネルギーなどの臨床情報を、ここ数年、本邦で発表された論文から抜粋してまとめた。また光源装置に関しては、本邦で上市され、PDTでも流用可能な装置を選択して、各項目別にメリットおよびデメリットを記載した。
簡便で、且つ、低侵襲であるPDTは患者のQOL向上 に有効な治療方法である。しかし現時点において薬事認可を取得していない以上、必ずしも安全性が担保されたわけではない。患者に安心してPDTを受けてもらうためにも、また皮膚科分野においてPDTが更に普及するためにも、PDTが早期に薬事認可を取得し、保険適応されることを期待してやまない。
最後に、本稿執筆に際して写真提供にご協力頂きました日本医科大学小坂祥子先生、およびこのような機会を与えていただきました愛知医科大学松本義也教授に深く感謝の意を表します。


