光技術情報誌「ライトエッジ」No.32(2009年5月発行)
光・量子デバイス研究会(電気学会)
(2009年1月)
光線力学治療(PDT)専用
メタルハライドランプの開発
Development of new metal-halide lamps for photodynamic therapy
木村誠*, 磯慎一(ウシオ電機株式会社)
Makoto Kimura*, Shinichi Iso(Ushio Inc)
New metal-halide lamps were developed for the purpose of the efficiency of photodynamic therapy(PDT)against the cancer cells, murine tymic lyphoma cells(EL-4), was investigated. 5-aminolevulinic acid-induced protoporphyrin IX(PpIX)was used as a photosensitizer. TheraBeam®VR of optical light sources for PDT was produced employing new metal-halide lamps. In addition, the clinical treatment for solar keratosis and acne vulgaris with ALA-based PDT(ALA-PDT)used the optical light sources considered that the light sources were effective against these diseases. These results, therefore, suggest that the phototherapy using TheraBeam®VR is clinically effective to reduce.
キーワード :光線力学治療(PDT), δ-アミノレヴリン酸(5-ALA), メタルハライドランプ, セラビーム®VR
Keywords : photodynamic therapy, 5-aminolevulinic acid-induced, metal-halide lamp, TheraBeam®VR
1.はじめに
光を用いた治療方法の一つに癌の光線力学治療(PDT)がある。PDTとは、腫瘍親和性のある光感受性物質を生体に投与したのち、病巣に光を照射し、癌細胞のみを選択的に破壊する治療法がPDTである。
PDTでは、光源としてレーザ光が主に用いられている。これは、生体内部に光りを送る際、内視鏡などに使用されている細径のファイバに光を効率良く入射することができ、十分な照射エネルギーを確保しやすいためである。また、波長も単一波長であることから時間による照 射エネルギー測定が容易に行えることや、照射面積が小 さいため毛細血管などの小さな病巣の治療には適して いることなどの理由も挙げられる。
しかしながら、皮膚科の分野でレーザ光を用いたPDTを行うには、ビーム径が小さいため、治療の面積が小さいこと、管理者や装置のための特別な設備を必要とすること、装置が大規模であること、メンテナンスが難しいことなど幾つかの問題点がある。
本稿では、治療面積がレーザより大きく、広範囲に照 射が可能なPDTに適応可能な光源装置について概説す るとともに、われわれが開発したPDT専用メタルハライドランプについて述べる。
2.PDT
2.1 PDTの原理
癌細胞に集積にされやすく、単独では細胞毒性を有しない特殊な光感受性物質(あるいは光感受性物質の前駆体物質)を投与して癌組織に選択的に蓄積させ、特定波長の光を照射することにより、組織内部での光感受性物質の光化学反応によって生成する活性酸素種あるいはラジカル種を細胞毒として利用して、癌組織のみを選択的に壊死させる治療方法である(1,2)。
具体的には、図1に示すように、生体内に光感受性物質を服用・注射・塗布することにより投与する。癌細胞と正常細胞とにおける光感受性物質の吸収・代謝時間が異なることを利用して、光感受性物質を癌細胞のみに蓄積された状態で光を照射する。光励起された光感受性物質(励起一重項状態)が、励起一重項状態から項間交差を経て励起三重項状態となり、さらに励起三重項状態から基底状態へ戻る間に、生体内の溶存酸素にエネルギーを転換したり、光酸素化反応を経て生成したフリーラジカル種が溶存酸素と反応したりして、活性酸素種であるヒドロキシラジカル、一重項酸素、過酸化水素、スーパーオキシドなどを生成し、癌細胞に傷害を与える。この原理 に基づいた治療方法がPDTである。(3)
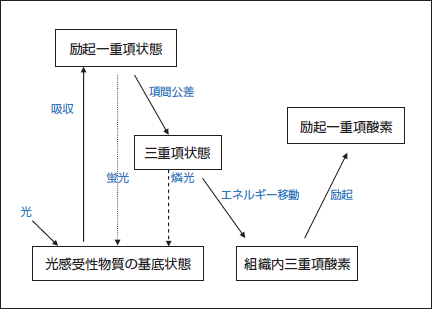
図1. 光感受性物質の光化学作用
Fig.1: Photochemical action of light-sensitive substance
2.2 光感受性物質
PDTは、光感受性物質の癌組織および新生血管への特異的な集積性と、その蛍光発光あるいは光励起による活性酸素種の生成を利用することを先に述べた。光増感作用を有する化合物は多数あるが、安全性を考慮し生体内に投与できるものは少ない。PDTに多用されている光感受性物質の一つにポルフィリン系化合物がある。ポルフィリン系化合物は四つのピロールがメチン(-CH=)基で結合した環状化合物で、植物界ではクロロフィルに代表され、動物界では血液中の酸素を運ぶヘモグロビンの基本骨格となっている。ポルフィリン系化合物は、共役系によるπ電子の非局在化に伴い、可視光領域に強い吸収を持っている。また、PDTに用いられる光感受性物質としては、ポルフィリン系化合物以外に、還元ピロールを一つ有するクロリン系化合物、二つの向かい合う還元ピロールを有するバクテリオクロリン系化合物、また合成ポルフィリンとしてフタロシアニン系化合物が用いられている。
現在、国内で認可を受けている癌治療PDT用光感受 性物質はヘマトポルフィリン誘導体(HpD、フォトフリン®)は、1ヶ月以上遮光生活を強いられ、副作用の日光皮膚炎の報告例が多いことから(4,5)、治療後、暗室の生活を余儀なくされる。さらに、低悪性度の癌への適用は制限されるなどの欠点もある。これらの問題を解決すべく1990年代に入ると第二世代の光感受性物質の研究が開始され、1990年にKennedyらが、代謝時間の短い(約3日程度)δ-アミノレヴリン酸(5-ALA)を発表し、局所塗布による基底細胞癌に対してPDTの治療成績が発表された(6)。
5-ALAはそれ自体には光感受性はない。また、ヘム生合成経路におけるポルフィリンの前駆物質である。生理的には一定量のヘムの産生されるとネガティブフィードバック機構によって5-ALAの生合成が阻害されるが、過剰な外因性の5-ALAが与えられると、ネガティブフィードバック機構が効かなくなり、ヘム生合成における律速酵素であるフェロキラターゼが枯渇し、生体内因性ポルフィリン化合物、特にプロトポルフィリンIX(PpIX)が細胞内に多量に蓄積される。このPpⅨを光増感物質として利用する。
PpIXの吸光スペクトルを図2に示す。PpIXは410nmに吸光係数が大きい吸収ピークがあり、他に510nm、545nm、580nmおよび630nmに小さいピークがある。表在性の疾患では主に410nm付近の光が用いられ、それ以外の皮膚疾患には皮膚での光吸収を考慮し630nmの光が利用されている(7)。
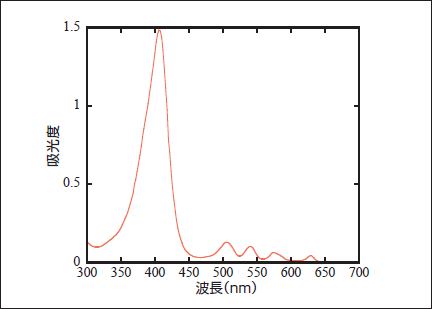
図2. ProtoporphyrinⅨの吸光度分布図
Fig.2: Absorption distribution of ProtoporphyrinIX
2.3 光源
PDTにおいて用いられる光は、①組織表面や血液成分に吸収され難い600nm以上の波長を有する必要がある。また、②照射中に組織に対して熱傷を起こさないこと、③光化学反応によって一重項酸素が生成するのに必要なフォトンエネルギーを有する必要があることを考慮すると、800nm以下の光である必要がある。つまり、PDTに利用させる光の波長は600~800nmに限定される(6)。
PDT用ランプ光源装置としては、現在国内で光線力学療法用として、厚生労働省の認証を受けている装置はない。しかし、欧州では薬剤と装置の許認可が別々に行われていることから、すでにPDT用光源装置として、ハロゲンランプ、キセノンランプ、照明用メタルハライドランプ、 蛍光ランプ、LEDを用いた治療装置が商品化されている(8-10)。現在商品化されている装置を図3に示す。
ハロゲンランプは、その出力の90%が赤外光領域にあるため、PDTに必要な600~800nmの成分は少なく、500~1000wの高出力ランプが用いられている。電源が不要なことやコストパフォーマンスが良いことなどの特長があるが、装置の冷却や照射患部の冷却が必要と なるなどの短所もある。また、キセノンランプや照明用メ タルハライドランプも同様で、出力波長がブロードな上、 赤外光領域に強い輝線を持っているため、冷却が必要 となる。さらに、フィルタ等でカットしても発熱を伴う放射 光の一部が直接患部に照射され患者に熱感を与えるといった問題がある。さらには、これらランプを使用して治療器を作製する場合、発熱量が高く、冷却用のファンや放熱フィンなどの熱対策はもとより、装置が大型化するためコストや装置サイズの問題点も抱えている。また蛍 光ランプでは、コストパフォーマンスは高いが、600~800nmの光変換効率が低く、電極間が広いため、結果的には放射エネルギーが低く、並べて使用するため、不要な場所(正常組織)にも照射してしまうという問題がある。LEDも同様で、1個当たりの照射エネルギーが低いため、並べて使用することになり、不要な場所(正常組織)にも照射してしまうという問題がある。しかしLEDはランプ光と異なり、光変換効率が高く、寿命も長いため、高効率化、光学系の改善が今後進めば、有望な治療器として期待できる。
3.PDT専用メタルハライドランプの作製と効果
メタルハライドランプは高圧水銀蒸気中に種々の金属ハロゲン化物(メタルハライド)を添加した高圧放電ランプであり、添加する金属元素が多様に選べるために非常に変化に富んだ光りが得られるランプである。
メタルハライドランプに封入される金属ハロゲン化物は、発光特性によって、大きく2種に大別される。一つは少数の強力なスペクトル線を発光する金属ハロゲン化物であり、もう一つは可視領域で連続的な分光分布を発光する金属ハロゲン化物である。
上述したPDTに用いられる光の波長を考慮し、PDTに用いることが可能な金属元素を表1に示す。われわれはこれまで、表1中の数種類の金属を選択し、PDT専用ランプを作製してきた。
PDT用ランプでは、630nm付近の吸収スペクトルに合わせ、バルブ中に水銀と金属ハロゲン化物、すなわちヨウ化ナトリウム、ヨウ化リチウム、ヨウ化カリウム、ヨウ化ルビジウムあるいはヨウ化ナトリウムとヨウ化リチウムの混合物を添加したランプを作製し、全照射面における放 射スペクトルの強度と均一性とを考慮して、ランプの陰 極と陽極との間のアーク長が短い高放射強度のショートアーク型放電ランプを作製した。
作製した放電ランプを用いて、皮膚科で主に用いられている光感受性物質である5-ALAを用いた癌細胞のinvitroにおける殺細胞実験を行った。その結果を図3に示す。図3の通り、Na-Liランプが最も高い殺癌細胞効果 を示した。(11)
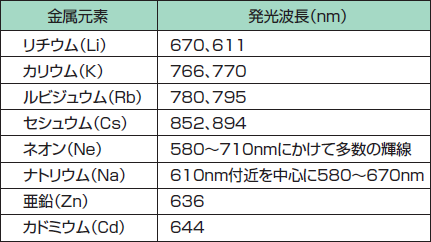
表1. PDTに利用可能な金属元素
Table 1: Metal elements for PDT used
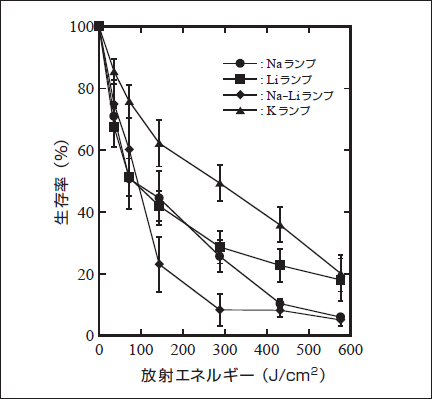
図3. 各PDT用放電ランプをガン細胞に照射したときの殺細胞効果
Fig.3: Cancer sells survival rate treating with discharge lamps
4.PDT用ランプ装置「セラビーム®VR」
作製したメタルハライドランプを用いてPDT用光源装置の開発を行った。光源装置を設計する際、皮膚科および形成外科領域での利用を考慮し、最大照射面を直径100mm程度の円形とした。そして操作性向上のために、2006年に赤外線治療器として薬事認可を得て発売している「セラビーム®VR630」をベースに、フィルタ交換可 能な「セラビーム®VR」(12)を開発した。図4に実際に作製した直射型光源装置の全体写真を示す。
光学系は全照射面に対する放射光の均一化を考慮して、ランプの輝点を対物レンズに結像させるケーラー照明法を採用した。また、視野絞りで迷光をカットし、コンデンサレンズ絞りで焦点深度が制御できるようにした。また、本装置はランプおよびフィルタを交換することでALA-PDT用以外にも、他の光感受性物質を用いたPDTとして用いることが可能である。
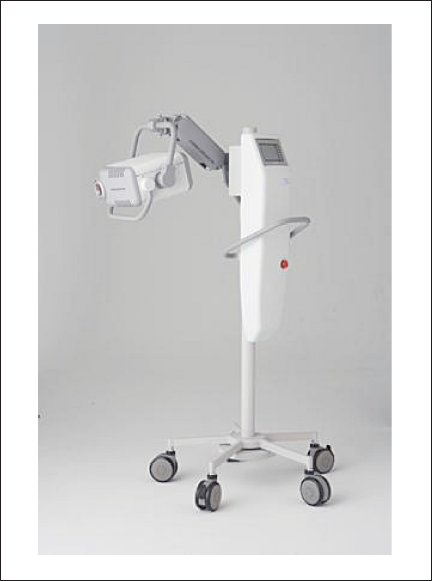
図4. セラビーム®VRの全体写真
Fig.4: Overall picture of Therabeam®VR
5.臨床効果
「 セラビーム®VR」を用いて、日光角化症(11)、Bowenoid Papulosis(13)および重度の尋常性ざ瘡(14)の治療臨床を実施した結果、高い治療効果を得ることができた。近い将来、PDTの機器として薬事認可が得られるように研究開発を進行中である。


