光技術情報誌「ライトエッジ」No.40
大学研究室を訪ねて Campus Lab㉕
光を用いた非侵襲的生体計測と病態診断への応用
京都府立医科大学 大学院医学研究科
細胞分子機能病理学 教授
高松 哲郎 先生
140年の歴史を礎に、新たな未来へ
――― 京都府立医科大学
京都府立医科大学は、1872(明治5)年の設立以来、140年の歴史を持ち、わが国で有数の伝統を誇る公立の医科大学である。
京都府立医科大学の設立に至る経緯は極めてユニークである。京都市民は、1868(明治元)年から、京都府を介して、日本政府に西洋医学の教員病院設立を嘆願していた。しかし、京都から東京への遷都の余波で、この願いは聞き入れられなかった。そこで、京都市民はお寺から寄附を募り、花街や町衆からも寄附を集め、遂に設立にこぎ着けたのである。青蓮院(京都東山の名刹)の境内に病院を建て、そこにドイツ人講師を招へいし、病院運営は京都府が受け持ったのである。
日本の多くの医科大学や大学医学部では、最初に教育施設がつくられ、その研修、実践の場として附属病院が設置されてきた。これに対して、京都府立医科大学は、府民の医療を第一とする病院がまずつくられ、次いで医療・医学を担う人材を養成する場として、大学が設置された。つまり、現在よく言われている地域医療を先取りした形で進んできたのである。以来、京都府立医科大学は、地域医療の要請に応えられる質の高い医師、医学者の養成という使命を担い続けてきた。 今日もこの設立方針は堅持され、府民からは「府立医大」「府立医大病院」と慣れ親しまれているが、これは大きな信頼が寄せられている証しでもある。
1952(昭和27)年の学制改革によって、新制大学となった京都府立医科大学は、1957(昭和32)年に大学院(医学研究科・博士課程)を設置し、その後、1971(昭和46)年には医療センター、1982(昭和57)年には附属小児疾患研究施設(愛称京都府こども病院)、1990(平成2)年には附属脳・血管系老化研究センターと、附属施設を次々と開設した。 看護学科は、1889(明治22)年開設の附属産婆教習所を母体とし、1976(昭和51)年の専修学校制度によって京都府立医科大学附属看護専門学校となり、1993(平成5)年には本学の医療技術短期大学部に移設されるなど、いくつかの変遷を経て、2002(平成14)年4月、現在の京都府立医科大学医学部の学科に生まれ変わっている。
たとえば大阪府立高等医学校は大阪大学医学部に、愛知県立医学専門学校は名古屋大学医学部にと、古い公立の医学校、医学専門学校は次々と国立大学に移管しているが、京都府立医科大学は国立への移管を拒み、文部省(現文部科学省)直轄による制約を受けない自由な気風を選択した。鴨川を挟んで、国立の京都大学と公立の京都府立医科大学が並立している今の姿に、その歴史の深さを感じさせる。
▼京都府立医科大学 河原町キャンパス
1921年開設。2012年7月に再建された門は、「病院や大学は、医学を学び、病気の治療をするだけでなく、心と体を癒し、育む場所である」と言う建築家・京都大学教授 高松伸先生によって設計された。それを象徴するかのように、陽が昇ってからは清潔感あふれる白が輝き、そして陽が沈んでからは、門灯の光が夜の闇に浮かぶ優しい白に変え、人々を癒す。

幅広い教養と専門医学教育の連携により、
医療・研究分野の第一線で活躍する人材を育成
京都府立医科大学では、病院の開設以来、一貫して、幅広い教養と専門に必要な基礎教育と医学教育との連携を重視してきた。そこで現行のカリキュラムにおいては、教養教育の講義と実習が行われ、第2学年からは、基礎医学教育が開始され、順次、社会医学、臨床医学の講義、実習が実施されている。
京都府立医科大学の教育理念は、国際的にも通用する一流の医師・医学研究者を育てることに尽き、単なる医療を施す医師、研究者の育成ではなく、社会の指導者としての人材を輩出することを使命としている。
モットーは、「世界のトップレベルの医学を府民の医療へ」。

▲東側全景(鴨川より)
京都府立医科大学の目的
本学は教育基本法により、学校教育法により定める大学として医学及び看護学に関する知識及び技能を授け、有能な医師、看護師、保健師及び助産師となるのに必要な教育を施すとともに、医学及び看護学の深奥を究めて、文化の進展と人類の福祉とに寄与することをもって目的とする。
最新の先端光学技術を細胞内機能分子の可視化に応用
―――細胞分子機能病理学 高松研究室
高松研究室は、バイオフォトニクス(最新の光技術とバイオテクノロジーの融合)による、機能分子のイメージングと機能制御技術を用いて、病気の発生メカニズムの解明を追究している。自ら開発した数多くの先端光学顕微鏡を駆使し、病態における機能的、形態的変化を分子、細胞、組織、臓器のレベルで、ビジュアルイメージでとらえることにより、病態の発生機序解明と革新的な画像診断技術の開発を目指している。
研究課題
- 1. 機能分子の可視化による心臓の病態、特に不整脈発生機構の解明
- 2. ギャップ結合細胞間コミュニケーションの異常と病態発生
- 3. シグナル分子としてのconnexinの役割
- 4. 様々なレーザ光を利用した生体イメージング技術と機能分子の制御技術の開発、及びそれらを利用した生体機能の解明
- 5. 腫瘍の内視鏡的超早期診断を目指したバイオフォトニクス基盤の解明

▲高松研究室のある棟(基礎医学学舎)

▲高松先生を囲む研究室の皆さん
うしろの建物は旧付属図書館。大学と共に歴史は古く、140余年に渡り、大学の教育・研究・診療活動を支えてきた。

▲光学顕微鏡による心臓組織観察

▲細胞培養の様子

▲心臓のリアルタイムカルシウムイメージングの様子
今まで見えなかったがんを見つける
5-アミノレブリン酸を用いた消化器がん転移リンパ節の診断支援技術の開発
2020年には3人に1人が65歳以上になると言われるほど、現在、高齢者は急速に増加し、これに伴い、がんの患者数も増加傾向にある。
「がんの診断方法」には、画像検査や腫瘍マーカーなどがあるが、最終の確定診断は、腫瘍の一部を切り取って、がんかどうかを判定する病理診断である。多くのがんはリンパ節を介して転移していく。このリンパ節の中でも、原発巣から一番近い位置にあるリンパ節を「センチネルリンパ節」と言う。「センチネル」とは「見張り番」を意味する言葉で、このセンチネルリンパ節に転移が見られない場合、切除する範囲が小さくてよい。そのため患者の負担が少なく、回復も早くなる。
しかし、非常に小さいがんは、形に変化が少ない、色彩の変化が少ない等の理由から、見つけることが困難とされ、がんを発見できるかどうかは臨床医の個人的な能力に頼っているのが現状である。現在の病理診断は、リンパ節を4-5ミクロンの厚みにスライスし、プレパラート標本を作成後、染色をし診断を行う。そのため、スライスから外れた小さな転移巣の場合見逃されることがある。また、診断にも20-30分程度かかることから、手術時間が延びる要因にもなっている。
これらの問題を根本的に解決しうる方法が、5-アミノレブリン酸(5-ALA)を用いた診断である。体外から5-ALAを投与すると、正常細胞では、5-ALAは蛍光物質を認めないヘムに素早く代謝される。一方、がん細胞では、プロトポルフィリンIX(PpIX)と呼ばれる蛍光物質が蓄積する。この原理を応用しているのが、5-ALAを用いた診断法である。
5-ALAを用いた診断法の利点
① 暗い背景のなかに、赤く光る蛍光として検出できるため、今までのように形や色彩の変化がない小さながんでも発見できる。
② 病理診断のように標本を作製しないため、3~5分という短時間で診断が可能になる。
5-ALAを用いた消化器がん転移リンパ節の診断は、蛍光を使用することで、今まで不可能とされた小さなサイズのがんを見つけることが可能となり、また、20~30分を要した病理診断のスピードを格段に速めることを可能とした。優れた診断支援技術として期待されている。
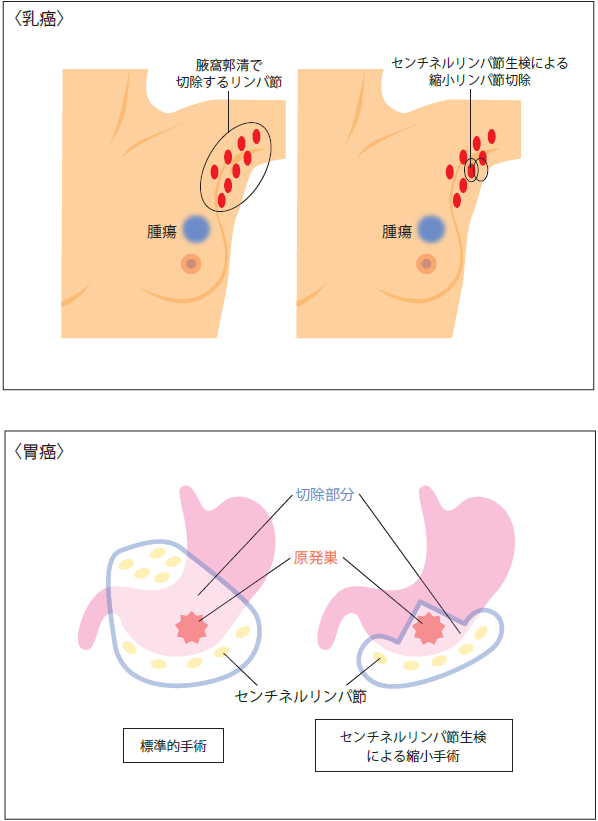
▲センチネルリンパ節による縮小手術
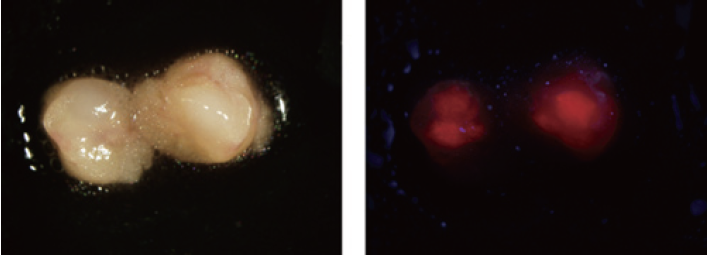
▲5-ALAを用いたヒト胃がんリンパ節転移イメージング(左:白色光、右:蛍光)
「蛍光を用いたがん診断」の開発
高松先生に聞く

発端は心臓への興味から
- Q1:先生は、世界で初めて、がんを光らせてリンパ節転移を発見するという「蛍光を用いたがん診断」技術を開発されました。なぜ、このような研究をするにいたったのでしょうか?
- A1: 実は、もともと心臓に興味を持っていたのです。心臓の細胞の固定標本を見ることで、心肥大や不整脈の研究をしていました。しかし、生きた細胞を見なければ分からないと思って、1987年に、当時バイオイメージングの最先端であったアメリカのメリーランド大学へ留学しました。そこでは、カルシウムイメージングの研究をしました。カルシウムというのは骨を作ったりする物質だと思われる方もおられるでしょうが、筋肉の収縮以外にも免疫反応や分泌、細胞同士のシグナルを送ったりと、様々な働きもします。セカンドメッセンジャーとも呼ばれ、細胞の機能制御に重要な役割を担っています。帰国後、そのカルシウムの研究過程で、臓器のままの状態で生きた細胞を見ることに成功しました。これなら、ヒトに対しても生きた細胞を見ることができるのではないかと考え、研究を続けてきた結果が、今行なっている診断支援システムの開発につながっていると思います。
2mmの小さながんを発見する
- Q2:今回の「蛍光を用いたがん診断」は、将来的にはどのようなことへ展開でき、どのような問題を解決していくのでしょうか?
- A2: 今まで2mmのがんというのは、ベテランの臨床医でも内視鏡を用いて見つけることは困難でした。それは、色でも形でも、正常な細胞とほとんど違いがないからです。蛍光を利用することによって、がんに特異的な分子をコントラストよくイメージングでき、形や色に変化の乏しい小さながんを検出できる可能性がでてきました。また、今までのがんの迅速病理診断は、がんであろうと思われる部分を切ってから、病理医が顕微鏡で診断していました。そのため、その間、患者さんは20~30分間待っているか、もしくは病理医のいない病院では、一度手術をした後、病理診断に切片を提出して、結果が出てから、また手術するという方法を取っていました。 私たちは、最良の診断というのは、スピードが早く、精度の高い診断であると考えています。今回の技術を利用すれば、蛍光による診断のため、小さながん細胞を見つけることができ、しかも診断スピードもはるかに速くなります。患者、病理医、外科医、3者の負担を軽減できると考えています。
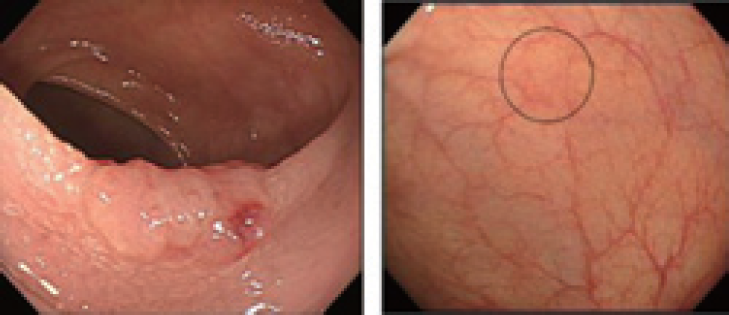
▲小さいがんの参考例(左図は進行した腫瘍、右図の丸部分が初期の腫瘍、初期の腫瘍には、形や色の変化が少ない。
- Q3:手法の開発にはいろんな困難があったと思うのですが、最も苦労されたことは?
- A3: 診断薬の選択です。動物実験でなら使える薬はあっても、ヒトに使える診断薬を見つけることですから、非常に難しかったですね。もともと、そういう薬や診断機器がなかった状態から探し始めたわけです。アイデアだけでなく根気のいる仕事でした。
好奇心が力に
- Q4:先生は当初、小児科医をされていましたが、途中から病理の世界へ移られています。なぜでしょうか?
- A4: 研修医を終了後、福井県の病院に2年間出張へ行ったのですが、その時、動脈管開存症と呼ばれる先天性心疾患を持つ多くの患児に出会いました。これは、通常、生後まもなく閉まるはずの動脈管が閉じずに残っていて、全身へ送られるはずの血液が大動脈から肺動脈へ流れ、心臓や肺に負担をかけてしまうという先天性の病気です。その研究をしている中で、プロスタグランジン拮抗剤で動脈管を閉めることができることを知ったのです。薬で先天性心疾患が治るとは、なんと素晴らしく画期的なことかと思いました。同時に、心臓の発生を細胞レベルでもっと深く勉強しなければならないと思いました。これが病理の世界への一歩でしたね。
見えないものを見るために
- Q5:先生は、過去に、日本で初めて「共焦点顕微鏡」を開発されましたが、なぜそれを作られたのか、また発表した際の反響もお聞かせください。
- A5: 私たちの身体は様々な組織から成り立っていますが、組織は細胞が重なりあっているため、調べたい細胞だけをうまく見ることができませんでした。そのため、深さ方向に分解能を持った顕微鏡が欲しかった。それが開発のきっかけです。
共焦点顕微鏡を開発していた大学院時代の1980年ごろは、ミニコンのメインメモリーが64KB、ハードディスクが20MB。値段も1000万円を軽く超え、サイズも相当大きいものでした。今のような小さくて高性能なパソコンはなく、ソフトも充実していませんでしたから、自分でインターフェイスを組んだり、プログラムを組んだり。でも、それが非常に楽しい時代でもありましたね。
そういった情熱が通じたのか、日本で初めて共焦点顕微鏡を開発できました。共焦点顕微鏡は、焦点面だけではなく、深さ方向を高い解像度で見ることができます。最初に見たのはホルマリン固定した標本だったのですが、得られた画像の素晴らしさとともに、固定によって生じるアーティファクトの酷さにも驚きました。開発当時は、非常に大きな反響をいただきましたね。これは、その後数年のうちに全国の大学や研究所にこの顕微鏡が設置されたことからもお分かりいただけると思います。
大学の研究をウシオが実現し、広めていく
- Q6:ウシオ電機との共同開発で、どのような相乗効果があるとお考えですか?
- A6: 私たちには、アイデアがあっても、きちっとした製品にする役割を持っていません。世の中へ広めていくこと、具現化していくことは、ウシオさんの領域だと考えています。また、蛍光で診断できると思っている人はまだ少ないと思います。光には吸収、反射、偏光、散乱など、さまざまな性質があり、光が医療へ展開できる余地は、まだまだあるのではないでしょうか。
新しい時代への期待と新しい創造のために
- Q7:最後に、先生が研究をされる際に気をつけていること、座右の銘などをお聞かせください。
- A7: 座右の銘ではないかもしれませんが、「ブラックボックスを作るな」と、教え子にはよく言っています。最近は、分析キットがあれば、すぐ色々なことが分かるようになりました。しかしその反面、どういった原理でその結果が出ているのか、知らない人が増えたように思います。原理をとらえた上でアウトプットを見ることで、見方が変わってくるはずです。
特に、新しい時代を築いていく若い人には、現象を原理からとらえて、新しいものを生み出していって欲しいと願っています。
羊土社発行「実験医学別冊」
主な研究発表
羊土社発行「実験医学別冊」
医療応用を目指した光による
in vivo分子イメージング
In vivo optical molecular imaging towards
applications to clinical diagnosis
原田義規、高松哲郎
Yoshinori Harada, Tetsuro Takamatsu
京都府立医科大学 細胞分子機能病理学
Department of Pathology and Cell Regulation,
Kyoto Prefectural University of Medicine
サマリー
光を用いて生体機能分子を可視化する分子イメージング技術は、様々な疾患の早期発見や病態を把握するための新たなツールとして非常に有用である。近年のレーザ発振器、分光器、検出器の性能向上により、ラマン散乱分光、生体内在性蛍光や非線形光学などを用いて、これまで測定することが困難であったヒト生体内機能分子をin vivoで直接可視化できる可能性が飛躍的に高まった。ここでは、将来医療応用を目指した光によるin vivo分子イメージングの試みについて自験例を中心に紹介する。
キーワード:ラマン散乱分光、生体内在性蛍光、光音響、非線形光学、医療応用
略語:5-ALA: 5-Aminolevulinic acid, PpIX: protoporphyrin IX,
NADH: nicotinamide adenine dinucleotide
はじめに
生体機能分子を可視化する分子イメージング技術は、癌や生活習慣病の早期診断に有用と考えられる。特に、光によるin vivo分子イメージ ングは、生体組織に対し安全性が高く、組織中に存在する細胞内機能分子を高空間・高時間分解能で観察可能であり、装置が比較的簡便で小型であるという医療応用上優れた特徴を持つ。しかし、これまで報告された光によるin vivo分子イメージング技術の多くは、標的分子を蛍光タンパクなどのプローブで標識する必要があり、医療応用するためには困難を伴う。光を生体組織に入射すると、その表面および内部で反射、屈折、吸収、散乱などの現象が起きる。これらを正確に測定すれば組織内機能分子の濃度や動きをin vivoで知る手がかりになるが、光と組織の相互作用は比較的弱く十分利用されてきたとは言えない。一方、レーザ発振器、分光器、検出器の飛躍的な性能向上、データ処理技術の進歩により、これまで測定することが困難であった微弱な現象を捉えることができるようになってきた。つまり、ラマン散乱分光、生体内在性蛍光、光音響、第2高調波などである。これらの技術は、生体組織の細胞レベルにおけるイメージングだけでなくプローブを用いない分子イメージングをも可能にしてくれる。我々は先端光学を駆使して、生体機能分子を制御・解析するための様々な技術・装置の開発を行ってきているが、ここでは将来的に医療応用を目指した光によるin vivo分子イメージングの試みについて紹介したい。
蛍光を利用した腫瘍イメージング
蛍光は、1)コントラストがよい、2)時間分解能がよい、3)多重染色が容易、4)光学顕微鏡の分解能以下のものでも見えるなどの特徴があり、生体診断に適した性質を持つ。しかし、ヒトに応用できるプローブの開発は難しく、使用される機会はこれまで限られていた。最近では、ヒトに用いることが可能な腫瘍特異性を持つプローブやプローブが不要な生体内在性蛍光を対象とした蛍光内視鏡も開発されつつある。
1)5-Aminolevulinic acid(5-ALA)を用いたリンパ節転移診断
消化管癌の治療法選択には正確なリンパ節転移診断が不可欠である。通常リンパ節診断は摘出された病理標本を用いて行われるが、通常2~3枚の病理標本を作製し診断が行われるため、微小リンパ節転移は見逃される可能性がありその感度に限界がある1)。近年、蛍光を利用した腫瘍イメージングが臨床においても行われるようになり、特に5-Aminolevulinic acid(5-ALA)は、膀胱癌や脳腫瘍において原発腫瘍の診断に実際用いられている2)3)。5-ALAは、正常細胞では蛍光を認めないヘムにすばやく代謝されるが、腫瘍細胞では、porphobilinogen deaminaseの活性が高くferrochelatase の活性が低いため、蛍光物質であるprotoporphyrin IX (PpIX) が蓄積する。すなわち、5-ALAを生体に過剰投与し一定の時間を経て観察すると、PpIXが腫瘍細胞に選択的に残存し腫瘍の蛍光診断が可能となる。我々はマウス直腸癌モデルを用いて5-ALAの微小リンパ節転移診断能を検証したが、簡便な方法で高い診断能を有する事が示唆された(図1)4)。ヒト消化器癌においてもこの方法がリンパ節転移診断に有効であるデータを得ている。
2)生体に内在する蛍光を用いた微小大腸腫瘍の検出
現在臨床において使われている内視鏡は大腸腫瘍の検出に有効であるが、主に形態的変化に基づき診断を行うため、形態変化の小さな微小腫瘍や平坦型腫瘍に対して十分な感度を持っているとは言えない5)。大腸内視鏡検査が形態変化の小さな腫瘍を見逃す頻度は高く、直径5~10mm、1~5mmの腺腫に対する見逃し率は、それぞれ13%、26%といわれている6)。我々は、形態変化に着目するよりも腫瘍化に伴う代謝変化に着目することが、内視鏡の診断能を上げるために有効と考えた。腫瘍は初期段階から代謝変化を伴い、また一般的に固形腫瘍は低酸素状態にあることが知られている7)。生体には数種類の内在性蛍光物質が含まれており、特にnicotinamide adenine dinucleotide (NADH)は細胞代謝に関連して蛍光強度が変化し、細胞が低酸素状態に陥るとNADH蛍光強度は上昇することが知られている8)。大腸癌の発生母地である大腸粘膜はNADHを豊富に含むため9)、大腸粘膜の腫瘍化をNADH蛍光強度の違いとして捉えられる可能性がある。ただ、生体内においてNADH蛍光を正確に測定するには、ヘモグロビンはNADHの励起光・蛍光を強く吸収するため、血液の影響を軽減・除去する必要がある。最近我々は、血液ヘモグロビンの光吸収の影響を除去可能な2波長励起蛍光イメージング法を開発し、ヒト大腸腺腫切除検体を用いてその高い診断能を報告した10)11)。2波長励起蛍光イメージング法は、NADH蛍光光量が最大となる波長を含むイメージ(Excitation:365nm)およびレファランス蛍光イメージ(Excitation:405nm)をそれぞれ取得後、画像間レシオ演算を行うことにより、腫瘍の血管密度や形状の影響の少ない腫瘍イメージングが可能な方法である(図2C,D)。すなわち、内視鏡的粘膜切除術を施行された大きさ3 mm以下のヒト大腸腺腫も高いS/N比で描出でき、in vivo においてラット微小大腸癌を検出可能であった。同方法は、蛍光レシオを擬似カラーとして表示する内視鏡システムを作製することにより比較的簡便に臨床応用可能であり、微小腫瘍の内視鏡的検出に有望である。
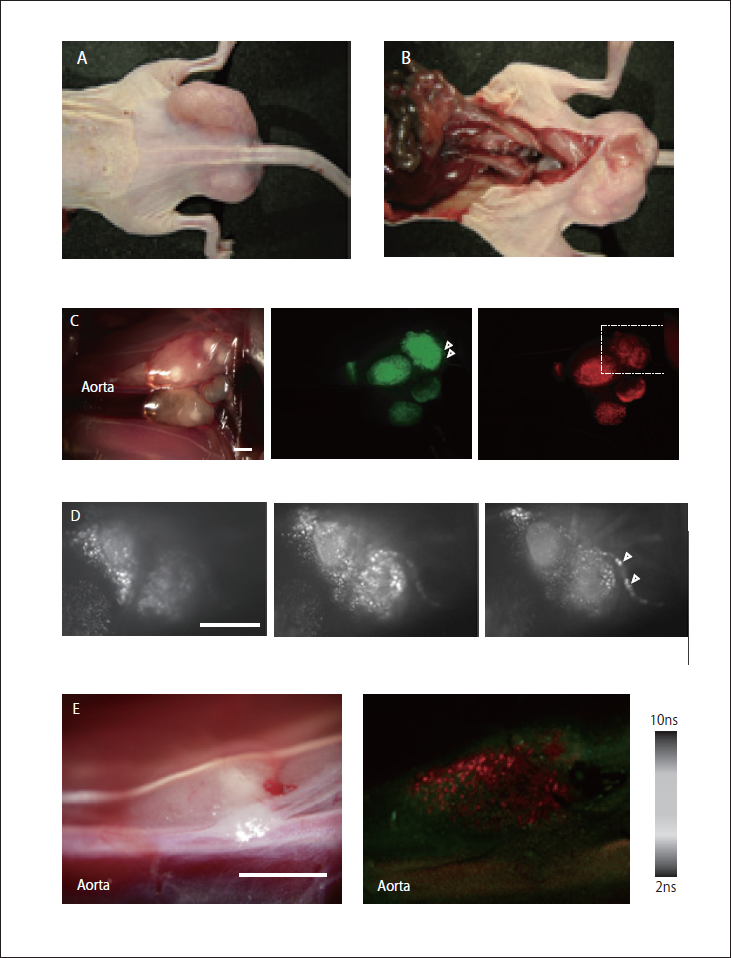
図1 5-ALAを利用したリンパ節転移イメージング
A) BALB/cヌードマウスの直腸粘膜下にEGFP標識大腸癌細胞を注入し、直腸癌リンパ節転移モデルを作成。 B) マウスモデルに5-ALA(250mg/kg)を静注後、開腹。C) 大動脈周囲リンパ節を観察(左: 白色光、中央:EGFP蛍光、右:PpIX蛍光)。5-ALA-induced PpIX蛍光はEGFP蛍光に一致することがわかった。D) Macroconfocal imaging systemを用いた光学的断層像(C右図の点線内をスキャン)。リンパ管内に存在するPpIX蛍光陽性の微小癌病変(矢頭)も描出可能。E) マウス腹腔内転移リンパ節の蛍光寿命イメージング。大腸癌転移部位の蛍光寿命は周囲の正常組織より長いため(癌転移部位:約10 ns)、転移巣を描出可能(左:白色光、右:蛍光寿命イメージング)。Scale bar = 5 mm (A, B), 1 mm (C, D, E() 文献4より転載)
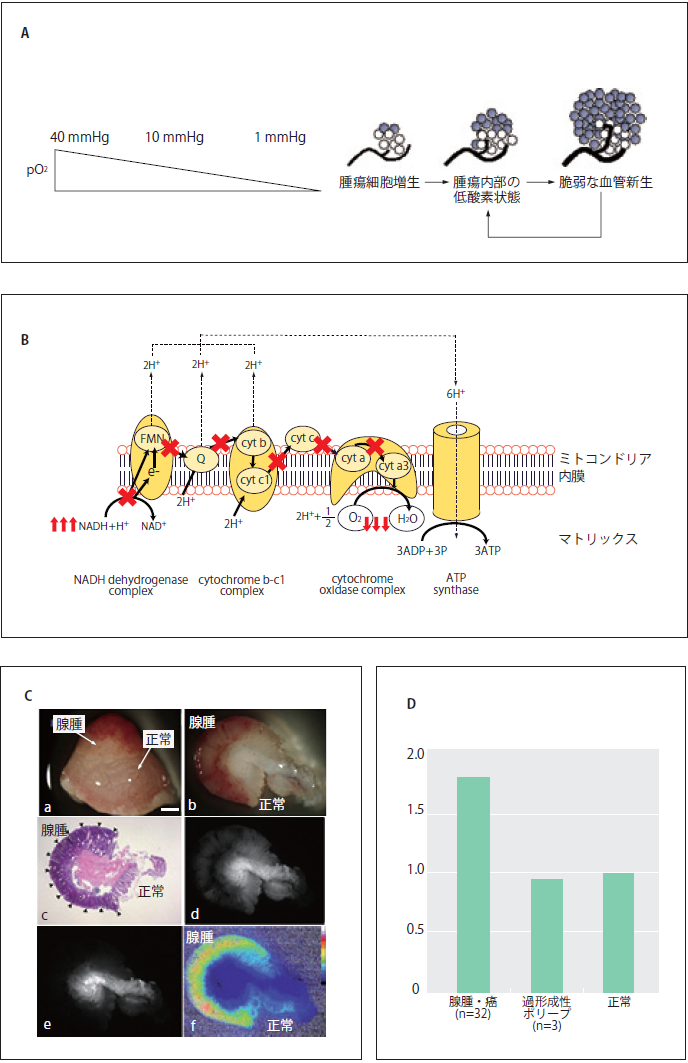
図2 生体内在性蛍光を用いたヒト大腸腺腫イメージング
A) 低酸素環境は固形腫瘍に共通した特徴である。がん組織はその発生初期から微小循環動態の欠陥等により恒常的に 低酸素状態にあるといわれている(J. Bull Cancer 2006;93:E73-80)。 B) ミトコンドリア呼吸鎖の模式図。細胞が 低酸素環境にさらされると細胞内NAD+/NADH redox状態は変化し、蛍光を持つNADHが増える。C) ヒト大腸腺腫 イメージング[a: 表面像(白色光)、b: 断面像(白色光)、c: 断面像(HE)、d: 断面像(NADH蛍光)、e: 断面像(レファレンス蛍光)、 f: 断面像(2波長励起蛍光イメージ:レシオ画像=NADH蛍光/レファレンス蛍光)]。2波長励起蛍光イメージング法を用いる ことにより、腫瘍の血管密度や形状の影響を受けない大腸腺腫イメージングが可能(C, D)。Scale bar = 1 mm
ラマン散乱光による心筋梗塞イメージング
光を物質に照射するとその一部は散乱される。散乱光の大半は入射光と同じ波長を示すが、一部は入射光と波長が異なる。この異なった波長の散乱光をラマン散乱と呼ぶが、波長のシフト量はその物質を構成する分子構造に固有であるため、測定されたラマンスペクトルを解析することにより構成分子の同定が可能である。すなわち、ラマン散乱分光は、生きた細胞・組織中に存在する分子の構造やその変化を非破壊・プローブなしで解析可能であり、in vivo診断に適した分光法といえる12)。しかし、ラマン散乱の散乱断面積は非常に小さいため、定点での解析に用いられることはあってもイメージングはほぼ不可能であったため、ラマン分光法は医学・生物学の領域であまり用いられてこなかった。
近年、光学技術の急速な発展により、生理的な環境下でかつ十分な速度でラマンイメージングを行えるシステムが登場してきており、ラマン分光法を生体機能解析に利用する道が拓けてきた13)。我々は、同時に多点の測定が可能なライン照明とパラレル検出技術を取り入れた高速ラマン散乱顕微鏡システムを用いている14)。つまり、532 nm励起によるチトクロームの共鳴ラマン散乱を利用し、主成分分析によるイメージ再構築を行うことにより、無標識でラット心臓(正常・陳旧性心筋梗塞巣)の生体組織診断が可能であることを示した(図3B-I)。この技術を用いて、我々はin vivo無標識生体組織診断を目指している。
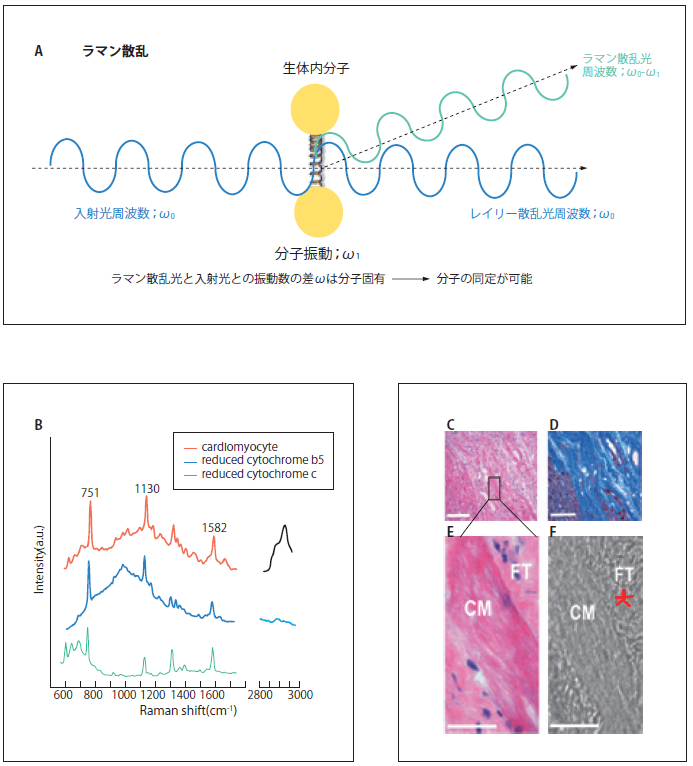
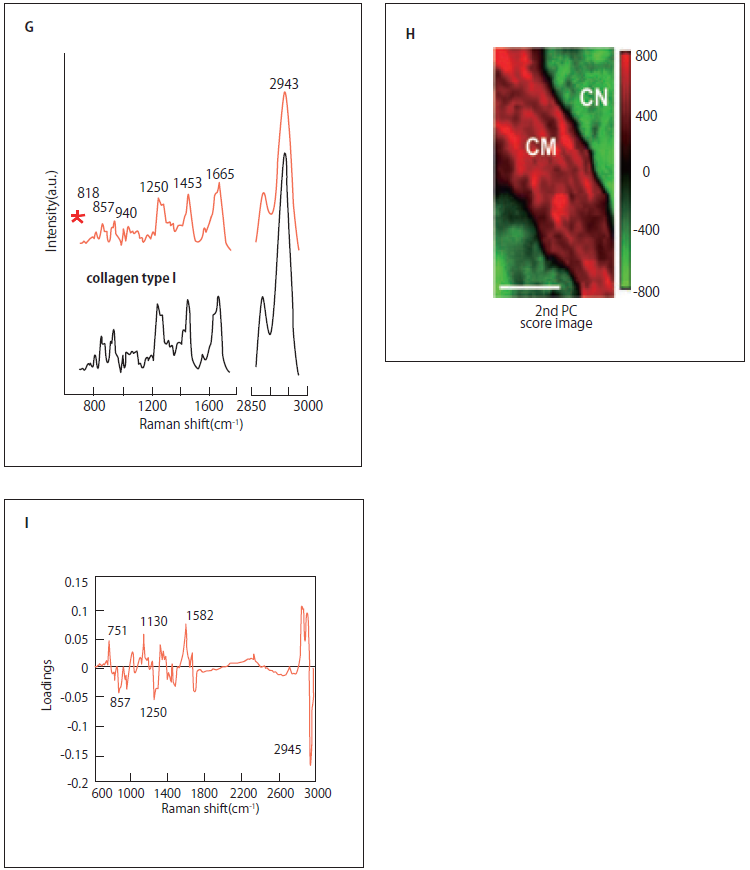
図3 ラマン散乱光による心筋梗塞イメージング
A)ラマン散乱の模式図。物質に光を入射したとき、入射光は違う波長で散乱される光をラマン散乱光という。このラマン散乱光は分子固有の分子振動に依存するため、ラマン散乱光を分光することで、分子の同定、構造を推定することが可能。B)心筋細胞のラマンスペクトル。心筋細胞のラマンスペクトルは還元型b5及びc型チトクロームの寄与が大きい。C) HE染色による心筋梗塞の境界領域イメージ。D) 線維染色による心筋梗塞の境界領域イメージ。E)Cのボックス領域の拡大イメージ。F)白色光イメージ。G)Fの線維性の組織(星印)とI型コラーゲンのラマンスペクトルの比較。H)Eの領域についてラマンスペクトル測定後、主成分分析した時の第2主成分ラマンイメージ。I) 主成分分析を適用した時の第2主成分ローディングプロット。正のバンドは還元型b5及びc型チトクローム(751, 1130,1582 cm-1)及び脂質(2854 cm-1)に関連。負のバンドはI型コラーゲン(857, 1250, 2945 cm-1)に関連。スケールバーは50µm(C, D);20 µm(E, F, H)。CM、ラット心筋細胞。
非線形光学を用いたイメージング
生体組織による吸収が少ない近赤外光による励起を行う2光子吸収は、組織に対する障害が少なく、より深部の励起を可能にするなどin vivoイメージングに優れた点を有する。2光子吸収の特徴は焦点のみで励起可能であることであり、組織内部の焦点領域以外に影響を与えない。最近、我々は生体深部観察へ向けた2光子励起光音響イメージング法を開発した15)。2光子励起光音響イメージング法は光の空間分解能のよさと音波の生体内長距離伝播特性を生かした新たな方法であり、ミリメートルを超える生体深部のin vivo観察に今後有用になると考えている。また、近赤外超短パルスレーザーは、蛍光寿命計測や第二高調波にも利用でき、形態観察にとどまらず、組織の質的状態を知ることができる。蛍光寿命イメージングを腫瘍診断へ応用した例や真皮コラーゲンの第二高調波発生光イメージングを皮膚老化診断へ応用した例などが知られている16)17)。
おわりに
現在医療の現場においてCT、MRI、PETなどのイメージング機器の果たす役割は大変大きく、必要不可欠である。しかし、これらのイメージング技術は原理的に低い時間・空間分解能や大掛かりな設備が必要などの問題点がある。一方、光を用いたイメージングは、分子を直接観察できる高い空間分解能とミリ秒のスピードで画像の取得が可能な高い時間分解能を持つとともに、大掛かりな設備は不要なためベッドサイドでの簡便な利用が可能である。今後、光による生体分子イメージング技術は、今回述べたプローブによる制限や組織深部の観察など医療応用を進めていくための課題を解決することによって、CT、MRI、PETとは異なる方向からの医療への貢献が期待される。
謝辞
以上で紹介した研究は、京都府立医科大学大学院医学研究科 村山康利氏、今泉克一氏、中野圭明氏、小川貢氏、山岡禎久助教、戴平講師、大辻英吾教授、夜久均教授とともに行い、独立行政法人 新エネルギー・産業技術総合開発機構(NEDO)、科学研究費補助金による研究助成などにより遂行された。
筆者プロフィール
原田義規:1992年、京都府立医科大学医学部卒業。1999年、同大学大学院終了。医学博士。2004年同大学大学院医学研究科細胞分子機能病理学助教。2009年より現職。研究テーマ:疾患の超早期診断に関わる光学基盤技術の開発など。趣味:テニス、ドライブ、子育て高松哲郎:1974年、京都府立医科大学医学部卒業。1982年、同大学大学院終了。医学博士。1995年同大学第二病理学教授。2003年より現職
プロフィール

高松 哲郎 (たかまつ てつろう)
京都府立医科大学 大学院医学研究科 教授
細胞分子機能病理学
- ■学位
- 医学博士(京都府立医科大学)
- ■経歴
- 昭和49年3月 京都府立医科大学医学部卒業
昭和53年4月 京都府立医科大学大学院医学研究科(内科系)入学
昭和57年3月 同医学研究科を所定の単位を修得の上退学
昭和57年6月 医学博士(京都府立医科大学)
昭和57年10月 京都府立医科大学助手、第二病理学教室勤務
昭和62年8月 日本病理学会認定病理医
昭和62年10月 米国留学、メリーランド州立大学医学部生理学教室( 平成元年6月30日まで)
平成07年4月 京都府立医科大学教授、第二病理学教室勤務
平成11年4月 京都府立医科大学学生部長兼務(平成15年3月31日まで)
平成15年4月 京都府立医科大学大学院医学研究科教授(統合医科学専攻)
平成23年4月 京都府立医科大学副学長就任(平成25年3月31日まで) - ■現在の専門
- 心臓の機能病理学、顕微鏡による生体計測と加工
- ■賞罰
- 1993年 第19回京都医学会学術賞(第一位)
2007年 日本病理学賞
2008年 Piet Van Duijn賞
2009年 京都府知事特別表彰 - ■学会等役員
- 日本病理学会評議員/日本組織細胞化学会理事長/日本細胞生物学会評議員
日本バイオイメージング学会理事/レーザ顕微鏡研究会幹事 - ■社会貢献
- 財団法人光産業技術振興協会 技術アドバイザ, 1997-2008
独立行政法人 新エネルギー・産業技術総合開発機構(NEDO)技術委員, 2002-2006
京都府 21世紀の府立の大学検討会議委員, 2003
独立行政法人 科学技術振興機構(JST) 研究成果展開事業産学共創基礎基盤研究プログラムオフィサー, 2011-現在 - ■連絡先
- 〒602-8566 京都市上京区河原町広小路梶井町465番地
京都府立医科大学大学院医学研究科 細胞分子機能病理学
電話:075-251-5322
FAX:075-251-5353
e-mai:l ttakam@koto.kpu-m.ac.jp


