(2016.08)
生物工学会誌 第94巻 第8号
ネオバイオ分子としてのQ-body
上田 宏1*・董 金華1・鄭 熙陳1・阿部 亮二2
1*東京工業大学科学技術創成研究院化学生命科学研究所(教授)
1 東京工業大学科学技術創成研究院,2ウシオ電機株式会社
はじめに
我々の体内では多くの機能性生体分子が他の分子と協同的に働き、その機能を果たしている。たとえば、もっとも多様性に富みその語源がギリシャ語で一番大切なもの(Proteios)であるタンパク質は、フラビン、NADHといった補酵素などの低分子と結合することで、またリン酸、メチル基、アセチル基などの低分子や糖鎖などの高分子に修飾されてその機能を十分に発揮したり精緻な調節を受けている。ネオバイオ分子工学の大きな目標は、このようなタンパク質と他の分子の新規な複合体の創出である。仮に天然タンパク質をベースにしていても、そこに新たな補因子を組み合わせることで、天然タンパク質のみでは実現できない新たな機能を創出できるのではないだろうか?本稿では最近筆者らが見いだした「抗原に結合して光る」蛍光標識抗体Quenchbodyを紹介するとともに、このようなタンパク―色素複合体のネオバイオ分子としての可能性を考えたいと思う。
たかが抗体、されど抗体
ご存じの通り、抗体は我々高等動物を外敵から守ってくれる獲得免疫系の主役ともいえる結合タンパク質である(図1)。各々の抗体の、ほぼありとあらゆる分子への特異的かつ強い結合能は、基礎科学的興味のみならず生物工学的応用の観点からいっても大変魅力的である。よって抗体は研究用試薬から診断薬、さらには治療薬として広く利用されており、特にヒト化抗体(抗体医薬)は現在の世界のバイオ産業を牽引していると言っても過言ではない。
抗体は、1890年の北里柴三郎とエミール・ベーリングによる血清療法の報告以来、これまでほぼ100年間、動物に抗原を注射(免疫)した後の血清から得られてきた(抗血清、ポリクローナル抗体)。さらに最近40年余りは免疫マウスの抗体産生細胞(B細胞)をミエローマ(がん)細胞と融合させて不死化し、得られた無限増殖可能なハイブリドーマから得られるモノクローナル抗体として、生物学研究の進展に大きく貢献してきた。しかし、マウス由来モノクローナル抗体の治療薬としての限界(ヒトに注射するとショックを起こす)を打破するための、その後の抗体工学研究者の必死の努力により、現在ではたとえば結合部位を人工的にランダム化したヒト抗体ライブラリを作製し、そこから目的抗体をファージ提示法などの方法で選択することが実用的に可能になってきた。
抗体は、その抗原結合部位(超可変領域)の構造はそれぞれの抗体(クローン)ごとに大幅に異なるものの、その他の部分の配列と立体構造はクローンによらずほぼ一定であり、モジュール的、工学的な思考にもなじみやすいタンパク質である。事実、抗原認識に直接影響しない定常領域を省略した数々の低分子化抗体(ScFv、Fab)が、その生産のしやすさ、組織浸透性の高さなどの理由で最近頻繁に使われている。これらのうち、ScFvはFvを構成する二つのドメインVH、VLをリンカーで結合させたタンパク質である。もしこのリンカーがないと、VH とVLは解離しやすいことが知られている。筆者らは以前、これを逆手にとって、抗原結合によるVH-VLの結合の安定化を測定する免疫測定法オープンサンドイッチ(OS)法を考案した1,2)。OS法は低分子抗原であっても非競合的に測定ができ、通常用いられる競合法に比べて感度と測定濃度域において有利であることが、数々の実験例で証明されている。
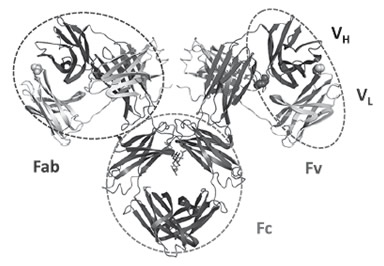
Fig.1:IgG抗体とその断片の構造(PDB 1MCOより)
Quenchbodyの発見と応用
ここでは紙面の都合で詳細を述べないが、抗体を用いた検出法(ELISA法をはじめとする免疫測定法)は、臨床診断における体液や環境中のサンプルに含まれる測定対象の高感度かつ比較的簡便な検出法として、現在大変ポピュラーな方法である3)。しかし同時に、数度の抗原抗体反応と洗浄、さらに検出に、時間と手間を必要とするのも事実で、研究者や臨床検査の関係者はともかく、一般人が気軽に使える分析法とは言いにくい面もあった。筆者らは、この問題を解決する方法の一つとして、サンプルと混合し、光を当てるだけで測定が可能な検出法を、上記のOS法に基づき構築した。その原理として当初考えたのは蛍光色素間のエネルギー移動(FRET)である(図2)。
VHとVLをそれぞれ緑と赤の蛍光色素で結合能を損なわないように修飾し、両者を混ぜて水色の光で励起し、それぞれの蛍光波長で蛍光を測定することで、サンプルと混ぜるだけの(ホモジニアスな)抗原検出が実現できた。ちなみに下線部分は決定的に重要であり、市販の蛍光試薬を用いた修飾法を用いて再現性良く行うことはかなり難しかったが、無細胞タンパク質合成系を用いた、翻訳反応時に蛍光修飾アミノ酸を取り込ませる方法4)の適用によって、ほぼ完璧にこれを行うことができるようになった。
しかし、その際行った比較実験で、VH断片だけをそのN末端近傍をリンカーを介して赤の蛍光色素(TAMRA)で標識し、非標識のVL断片と混合したところ、なぜかTAMRAの蛍光強度が抗原濃度依存的に増大する現象が見いだされた。さらにだめ押しとなる結果として、N末端近傍をTAMRA標識したScFvを用いると、この効果がさらに顕著に観察された(図3a)。すなわち抗原(骨疾患マーカーであるオステオカルシンBGPのC末ペプチドBGP-C7)添加により、TAMRAの蛍光強度が最大5.6倍に向上した(図3c)。
この際用いた励起光は緑色、色素はTAMRAだけなので、この蛍光変化がFRETによるものとは考えにくい。その後の変異導入などの検討により、この蛍光変化は抗体VH、VL中にあるトリプトファン(Trp)からの、光誘起電子移動による色素の消光(クエンチ)であることが判明した。よってこれより筆者らはこのような性質を持つ蛍光標識抗体断片をクエンチ抗体(Quenchbody,Q-body)と呼ぶことにした5)。
幸い、抗体VH、VL断片中のTrp残基の位置はほぼ保存されており、低分子からタンパク質までさまざまな抗原を認識する多くの抗体でQ-bodyを構築できることがわかった。また、BGP認識Q-bodyでは50%血漿中でもリン酸緩衝液中とほぼ同じ検量線が得られ、さらに、ScFvのみならずより天然抗体に近い構造のFab断片でも確かめられた6)。その際、興味深いことに、ScFvよりFabの方が、Q-bodyとしてより優れた応答を示した(図3b、c)。おそらく、安定性の高いFabではクエンチ状態がより安定化されるのであろう。またFabの場合、修飾位置は基本的にVHあるいはVLのN末端側が良いが、両方に修飾した場合により高い応答が得られることも多い。これは色素間の相互作用(Hダイマー形成など)に由来するクエンチを利用できるためと考えられる。また、超可変領域でない、抗原結合に関与しないループ(CDR4とも呼ばれる)を修飾した場合に最適な応答が得られた例もある7)。また色素としてTAMRA以外にも、色調の異なる数種の主にローダミン系色素が利用できることが確かめられている8)。
また、やや導入に敷居の高い無細胞発現系を使わずとも、大腸菌で組換え体として発現、精製したScFv、Fabを用いてQ-bodyを作製することも可能である9)。その場合、N末のタグ中にシステイン(Cys)を入れておき、市販の色素マレイミドで標識すればよい。
またQ-bodyを用いると、より簡便に細胞イメージングを行うことができる。従来用いられている蛍光免疫染色法では、画像を得るためには染色後のフリーの(抗原に結合していない)蛍光抗体の洗浄除去が必須であった。これに対し、Q-bodyを用いればQ-bodyを細胞上清に添加し、数分放置するだけで細胞表面タンパク質のラベリングと蛍光観察が可能となる。現時点で骨芽細胞により発現された細胞膜上のオステオカルシン、さらにがん細胞上の抗原Her2の可視化に成功している。この手法を発展させ、将来、たとえば細胞内抗原のイメージングが自在に可能となれば、それこそがQ-bodyの本領を発揮する道になり得ると期待している。
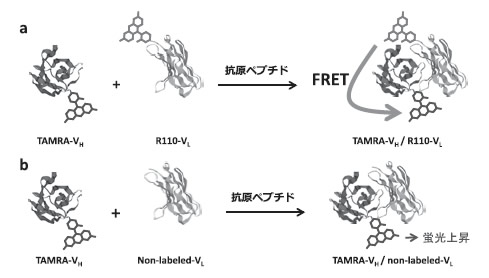
図2:オープンサンドイッチ蛍光免疫測定法(a)と発見され た現象(b)の模式図.
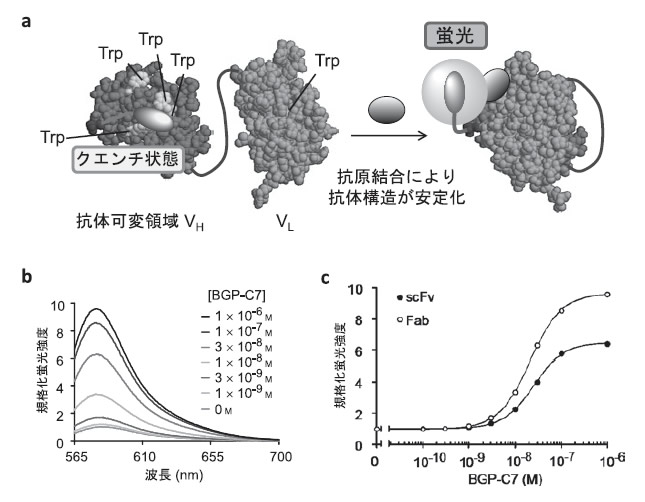
図3:Q-bodyの蛍光応答.(a)ScFv型Q-bodyの動作原理,(b)Fab型BGP Q-bodyの抗原依存的蛍光スペクトル変化,(c)ScFv 型とFab型Q-bodyの蛍光応答の比較
天然抗体Q-body化の試み
筆者らは、最近報告されたタンパク質のアミノ基転移反応に基づくN末端修飾法10)を応用し、修飾用Cys残基のないFabタンパク質をQ-body化することに成功した11)。この方法では、抗体N末端のアミノ基を特異的にケトン化し、ヒドロキシアミンあるいはヒドラジドを持つ蛍光色素(TAMRA)で修飾する(図4)。この際、N末端近傍のアミノ酸配列によりケトン化の効率が異なることを利用し、あらかじめ短い配列を付加することでH鎖・L鎖をほぼ選択的にラベルすることができた。本法ではフォールディングに悪影響を及ぼしかねないCys残基を修飾に用いないため、Q-bodyの収量増加も期待できる。この方法で作製したFab型Q-bodyを用いて、従来法に近い感度でBGP-C7の検出ができた。本法の条件検討、あるいは類似の可変領域特異的修飾法12)を用いることで、近い将来、あらゆる抗体をタンパク質レベルでQ-body化する方法が確立できれば、と考えている。
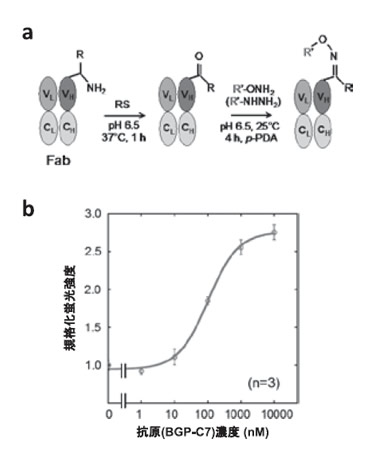
図4:アミノ基転移反応を用いたアミノ末端修飾法(a)とこ の方法で作製されたQ-bodyの検量線(b).RS: Rapoport’s salt; PDA: phenylenediamine.
おわりに:Q-bodyの更なる発展をめざして
以上、Q-body発見の経緯と現状でできることをお示しした。今後の方向性として、第一に考えられるのは分子進化的手法の導入によるQ-bodyに適した抗体の選択である。抗原結合部位にTrp残基の多い抗体、VH/VL間相互作用変化の大きい抗体、また将来的にはその他の結合分子の創生も考えられる。さらに直接、抗原の有無での蛍光変化の大きな抗体を選択できれば、より確実に選択が可能になろう。Q-bodyが「ネオバイオ」の基盤分子の一つとして、免疫測定の世界に新風を巻き起こす可能性に期待している。
謝辞
本稿の成果は、北陸先端科学技術大学院大学芳坂貴弘教授、ウシオ電機高木広明博士、大橋広行博士および多くの共同研究者・学生諸君の助力によるものであり、ここに感謝の意を表します。

