光技術情報誌「ライトエッジ」No.41(2014年12月発行)
バイオセンサの迅速・簡易・高機能化技術と課題解決書(技術情報協会2013.10)
実用可能な
SPR向けセンサチップの開発
北川鉄也
1. SPRセンサを用いた医療診断システム
はじめに、SPR向けセンサチップが使用される実用可能な医療診断システムに求められるシステム構成の概要を説明する。
1.1 SPRセンサ
表面プラズモン共鳴(以下、SPR)センサは、数pg/mL(ppt)程度の微量な被検物質を高感度に検出することが可能であり、このSPRセンサを、環境モニタリング・食品分析・医療診断・爆発物検知などへ応用した研究が数多く報告されている。
SPRセンサを用いた医療診断は、例えば、臨床検査等における免疫反応などの分子間相互作用(生化学反応)のセンシングである。すなわち、SPRセンサの測定領域にて生化学反応を発生させ、その結果生じる反応生成物の状態が、SPRセンサにより検出される。
1.2 センサチップ
SPRセンサの測定領域において効率的に生化学反応を発生させるためには、一般に、マイクロスケールのマイクロチャンネルとも呼ばれる流路が形成されたセンサチップ(マイクロチップ)が用いられる。センサチップ内の流路は、例えば、試薬が配置された反応領域が設けられており、分析用チャネルとして設計される。この分析用チャネルにおいて、微量の試薬の分離、合成、抽出、分析などが行われる。
よって、高感度な検出手段であるSPRセンサ、および微量の試薬を用いた生化学反応を発生可能な手段であるセンサチップを用いることにより、SPRセンサを有する体外分子診断システムなどの医療診断システムを構築することが可能となる。
特に、SPRセンサを小型化することにより、このような医療診断システムは小型軽量化され、POCT(point-of-care testing)機器としても期待される。
1.3 SPRセンサを有する医薬診断システムの信頼性
SPRセンサを有する医薬診断システムの信頼性は、センサチップ内で発生させる生化学反応の再現性に大きく依存する。例えば、体外分子診断システムとしてSPRセンサを有する医薬診断システムを用いる場合、体外分子診断システムの高信頼性を得るためにはセンサチップ内で安定かつ再現性の高い抗原抗体反応の実現が要請される。
具体的には、センサチップの流路内への安定かつ再現性の高い抗体固定を実現し、量産されるセンサチップ間のばらつきをできるだけ小さくすること、センサチップへの流路内への抗原を含む試薬の供給を再現性よく安定に行うことが必須の要件となる。
SPRセンサとセンサチップからなる体外分子診断システムの実用化がこれまで実現されてこなかった要因は、このような要件を充足することが困難であったためである。
抗体が固定されたセンサチップの製造は、センサチップの流路に抗体を含む試薬を供給して、流路内の金属薄膜に抗体を固定することにより行われるが、現状、センサチップ内への抗体を含む試薬の供給は、作業者の手作業で行われている。そのため、センサチップへの抗体の固定状態は、センサチップ間でばらつきが生じる。また、抗体の固定自体が不十分となり、測定時に抗体の固定状態に起因するエラーが発生することがある。
また、生化学反応を使った測定では、正確な実験操作が要求されるため、測定者には熟練したスキルが要求される。例えば、流路内に抗体が固定されたセンサチップに対して、この流路内への抗原を含む試薬の供給は、現状、手動で行われている。よって流路内への試薬の安定供給は、測定者の習熟度に依存することになる。すなわち、実験操作のわずかな誤差がアッセイ感度の大きなエラーに繋がる。このような現状がSPRセンサを有する医薬診断システムを一般に広く使われるようにするための大きな障害となっていた。
1.4 SPRセンサを有する医療診断システムの構成
既にウシオ電機株式会社は、高感度な生化学反応の高感度センサ技術と反応量、反応速度制御を実現できる完全自動化されたSPR測定装置を開発済みであり、常に安定した生化学反応測定を実現している1)2)。
図1にこのようなSPR測定装置からなる医薬診断システム(体外分子診断システム)の構成を模式的に示す。図1に示すように体外分子診断システムは、(A)検査用光源、光学系を含むSPRセンサ装置、(B)生化学反応をSPRセンサの測定領域で発生させるためのセンサチップ、(C)センサチップの流路に試薬を導入したり、センサチップの流路から廃液を排出するための検体送液・排出ユニット、(D)これらを制御するコントローラから構成される。
ウシオ電機株式会社では、(a)高感度のSPRセンサ装置、(b)良好な抗体固定再現性を可能としたセンサチップ、(c)工業用プラント装置にて採用される流量、温度、圧力を厳密に制御する高度プロセス技術を適用した検体送液・排出ユニット、(d)これらを制御するコントローラをそれぞれ開発し、システム化することにより完全自動化された体外分子診断システムを実現した。なお、検体送液・排出ユニットには、これまで工業用プラント装置を手がけてきた計装・制御メーカーである矢部川電気工業株式会社の協力のもと、高度プロセス技術が適用されている。
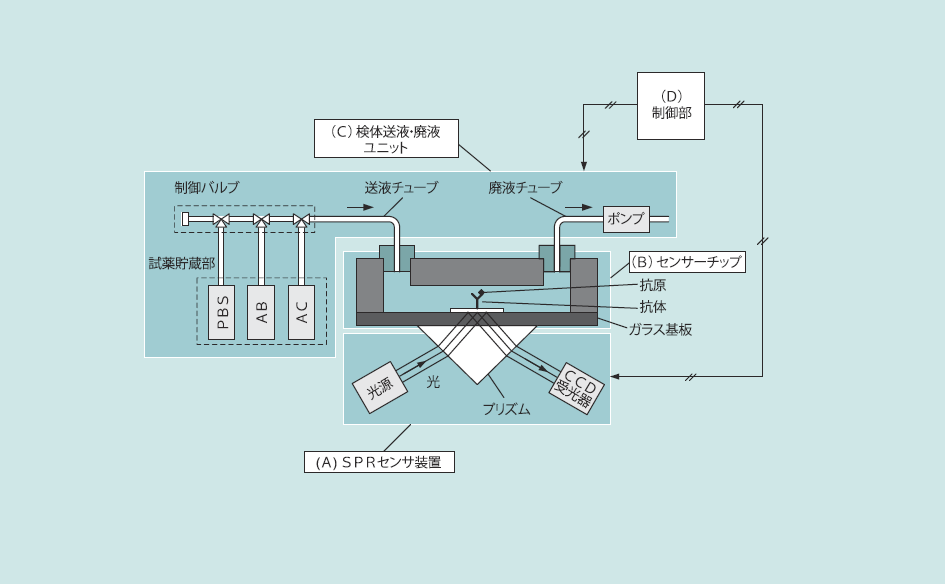
図1
2. SPR向けセンサチップの開発
2.1 センサチップ
センサチップは、典型的には一対の基板が対向して接着された構造を有し、少なくとも1つの上記基板の表面に微細な流路(例えば、幅10~数100µm、深さ10~数100µm程度)が形成されている。これまでセンサチップには、製造が容易であり光学的な検出も可能であることから、主にガラス基板が用いられている。また、最近では、軽量でありながらガラス基板に比べて破損しにくく、かつ安価な樹脂基板を用いたセンサチップの開発が進められている。
2.2 初期試作センサチップ
ウシオ電機株式会社にて初期に試作されたセンサチップは、Au(金)薄膜が成膜されたガラス基板とリソグラフを使ってマイクロ流路を形成させたシリコーン樹脂基板とからなる。両基板の貼り合わせは、両基板の貼り合わせ面にエキシマランプ光源(ウシオ電機株式会社製)から放出される真空紫外光(波長172nm)を照射後、両基板の真空紫外光照射面(貼り合わせ面)が密着するように両基板を積層し、両基板に圧力を加えることにより行った3)。
当初は、図2に示すように、このセンサチップの流路の開口部に送液チューブ、廃液チューブを取り付けて、流路内の金属薄膜上に抗体を固定していた。すなわち、作業者の手作業で送液チューブから抗体含有溶液をセンサチップの流路内に送液し、抗体を金属薄膜に固定させた。送液した抗体含有溶液は廃液チューブから排出される。抗体は生体分子であるので、大気に暴露されると失活する。そのため、製造したセンサチップの保管時に金属薄膜に固定した抗体が大気と接触して失活する可能性を排除するために、センサチップの流路内にはリン酸緩衝溶液(PBS)を満たした。また、流路の開口部はパラフィンフィルム等の封止材でシールした。
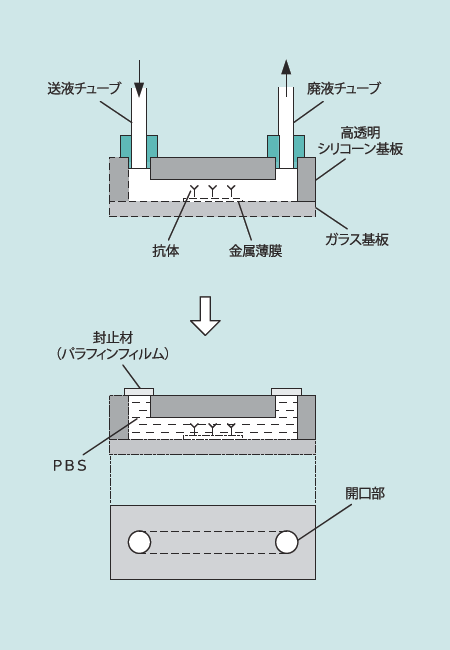
図2
2.3 初期試作センサチップの問題点
初期試作センサチップにおいては、流路内への抗体含有溶液の送液の際、流路に固定する抗体の大気暴露が発生することが判明した。大気に露出している開口部に送液チューブ、廃液チューブを着脱させる場合、開口部においてバブルが発生しやすい。図3に示すように、開口部で発生したバブルが流路内を移動すると、このようなバブルの一部は抗体内に固定される抗体と接触する。すなわち、抗体は大気に暴露されることになるので、抗体によっては失活する。同様に、センサチップの流路内に固定した抗体に対して抗原を含む試薬を流通させるの先立ち、センサチップの開口部をシールしているパラフィンフィルム等の封止材を除去する際においても、図4に示すように、開口部においてバブルが発生しやすく、発生したバブルと接触した抗体は失活する。
センサチップ流路内への抗体固定化作業において発生する抗体の大気暴露は、初期試作センサチップの著しい性能低下の原因となる。また、このような抗体固定化作業は作業者の手作業により行われるので、作業者の作業習熟度にバブルの発生度合いが左右される。すなわち、作業者の手作業による抗体固定化作業に起因するセンサチップ間のばらつきが発生する。
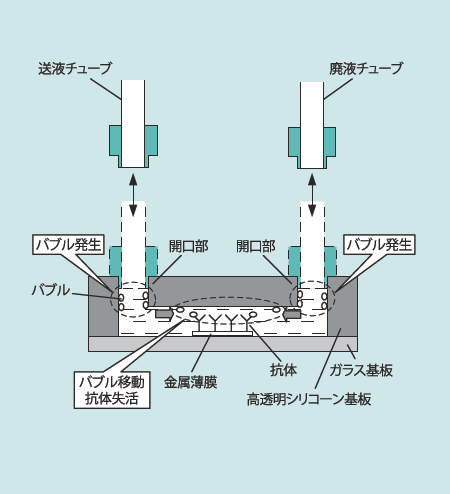
図3
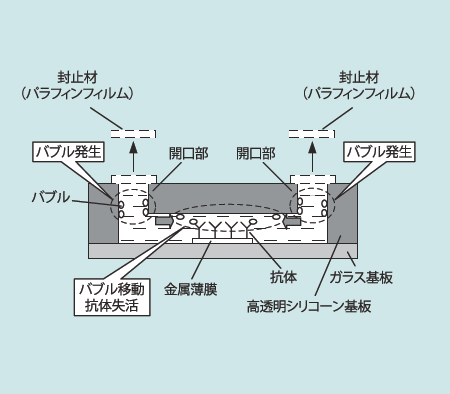
図4
2.4 実用可能なSPR向けセンサチップ
センサチップを実用可能にするには、作業者の作業習熟度には左右されることなく、大気暴露させずに抗体を流路内に固定可能であることが要請される。すなわち、センサチップへの抗体固定化作業において、流路内への抗体含有溶液の送液期間中に抗体への大気暴露が発生することなく、流路内の金属薄膜上抗体を固定化するシステムを構築する必要がある。このような要請を鑑み、ウシオ電機株式会社では初期試作したセンサチップに改良を加え、図5に概略的に示すようにセンサチップの開口部を有する上層面に新たに高粘着剤からなる高粘着材層を設けた改良型センサチップを構築した4)。
高粘着材層は、自己修復性封止機能を有する粘着性材料である。すなわち改良型センサチップは、高粘着材層により流路の開口部を閉塞した構造である。
図6に示すように、流路チューブ、廃液チューブを流路の開口部へ装着・離脱させる際、流路チューブの先端に設けた流体放出部、廃液チューブの先端に設けた流体回収部は高粘着材層を貫通する。自己修復性封止機能を有する高粘着材層は力が印加されると変形し、力の印加を解除すると力の印加前の形状に戻る性質がある。よって、流路チューブ、廃液チューブを流路の開口部へ装着された際、流体放出部、流体回収部と高粘着材層との接触部における密着性は良好であり、この接触部から外部の空気は閉塞空間である試薬配置領域に殆ど進入しない。
また、流路チューブ、廃液チューブを流路の開口部から離脱させる際においても、高粘着材層を貫通、離脱する流体放出部、流体回収部により高粘着材層に生じる孔も速やかに閉塞される。よって、流路チューブ、廃液チューブが改良型マイクロチップの開口部から離脱後も閉塞空間である抗体が固定された流路への外部からの空気の流入を防止することが可能である。
このように改良型センサチップは、流路チューブ、廃液チューブの装着・離脱させる際、空気が流路内に進入しない構造を有するので、作業者の作業習熟度には左右されることなく、大気暴露させずに抗体を流路内に固定することが可能となる。なお、センサチップへの抗体固定化を行う前に流路に存在する大気は、抗体固定化作業に先立って流路チューブより流路内にPBSを流して廃液チューブから回収することにより、流路からパージされる。
改良型センサチップは、高粘着材層により流路空間内への外部からの大気流入を防止可能にする構造であるので、初期型センサチップのように、製造したセンサチップの保管時に開口部をパラフィンフィルム等の封止材でシールする必要はない。すなわち封止材の除去に伴うバブル発生の問題も回避されることになる。
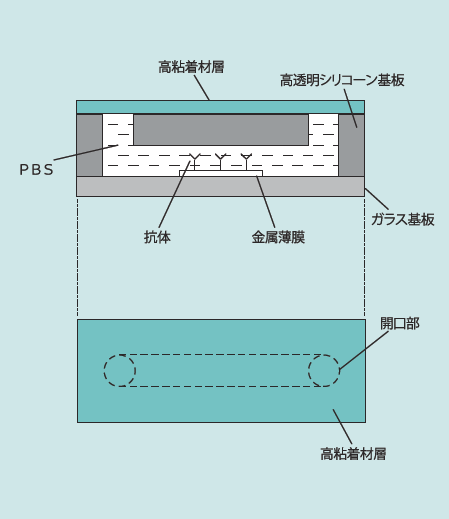
図5
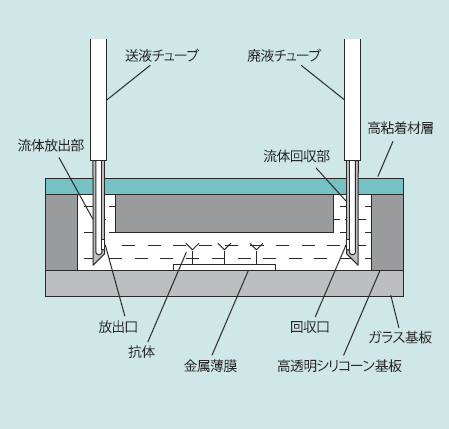
図6 計測結果
2.5 改良型センサチップと検体送液・排出ユニットとの接続
これまで実用可能なセンサチップとして、抗体を流路内に固定化させる際、抗体の大気暴露を抑制可能なセンサチップを提示してきた。このようなセンサチップと、先に述べた高度プロセス技術を適用した検体送液・排出ユニットとを効果的にジョイントさせることで、SPRセンサを有する医療診断システムの信頼性・再現性が向上する。
例えば、図6に示すように、センサチップの高粘着材層を貫通、離脱する流体放出部、流体回収部を尖塔型導入口構造(先端がベベル形状の注射針構造)とすることが好ましい。このような構造を採用することにより、作業者の作業習熟度に殆ど影響されることなく、容易に流体放出部、流体回収部をセンサチップの高粘着材層に対して貫通、離脱させることが可能となる。
また、先端がベベル形状の尖塔型導入口構造においては、先端部が閉鎖されており、流体放出部の放出口、流体回収部の回収口は側面に設けられている。そのため、流体放出部、流体回収部が高粘着材層を貫通する際に、高粘着材層の切屑はほとんど発生せず、また、放出口、回収口が高粘着材層の切屑により詰まることもない。
図2に模式的に示す送液チューブ、廃液チューブとセンサチップとのジョイント構造では、流路を流れる抗体含有溶液は乱流となり、その影響により抗体含有溶液中の抗体と金属薄膜との接触が乱れ、金属薄膜上への抗体の固定が必ずしも均一、かつ、十分に行われるとは限らない。ここで、図6のように、流体放出部の側面に設けられる放出口と流体回収部の側面に設けられる回収口とを互いに対向するように配置することにより、流体放出部から供給される試薬は、流路内をスムースに流れて流体回収部の回収口部から回収され、流路に流れる試薬が乱流となるのを抑制することができる。
おわりに
実用可能なSPR向けセンサチップとして、大気暴露抑制型のセンサチップを提案した。しかしながら、SPRセンサを有する医療診断システムの信頼性・再現性の向上には、厳密に管理された環境下での抗体固定が必須である。そのためには、高精度のプロセス技術を適用した検体送液・排出ユニットが不可欠であるし、検体送液・排出ユニットとセンサチップとのジョイント構造も再現性が高く、かつ、流体力学を考慮したものでなければならない。
最終的には、SPRセンサ装置、センサチップ、検体送液・排出ユニット、これらを制御するコントローラから構成される医療診断システムを完全に自動化して、このシステムによりセンサチップ内への抗体固定化作業を実施することで、実用化に適した抗体・抗原の選定や開発を前提として、エラー、ばらつきが低減されたバイオセンサチップ(流路に抗体固定化済み)の量産化が可能となる。
また、このようなばらつきのないセンサチップを使用した完全自動化された医療診断システムによれば、これまで専任の技術者によって行われてきた医療診断と比較して、医療診断の信頼性は実用レベルにまで向上することが期待できる。


